已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图。请回答:
(1)基态E3+离子核外有 种运动状态不同的电子。
(2)写出B的单质与水反应的离子方程式 ;
(3)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 。
(4)A与B形成的化合物在气态时存在(AB)2二聚分子,原因是 ;A与B形成的化合物比A与C形成的化合物熔点要____(填高或低)
在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应,各物质的起始加入量如下:A、B和C均为4.0 mol、D为6.5 mol、F为2.0 mol,设E为x mol,当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置,请填写以下空白。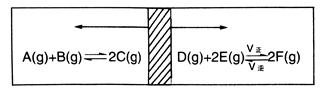
(1)若x=4.5,则右侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,要使起始反应维持向该方向进行,则x的取值范围__________。
(2)若x=4.5和5.0,则在这种情况下,当反应达平衡时,A的物质的量是否相等?__________(填“相等”、“不相等”或“不能确定”),其理由是__________________。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。
在0~60s时段,反应速率v(N2O4)为mol•L-1•s-1;反应的平衡常数K1=mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2=mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向(填“正”或“逆”)反应方向移动。
在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2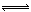 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)
(10分) 用“>”、“=”、“<”填写。
(1)常温下,将0.1mol/L的醋酸溶液和0.1mol/L醋酸钠溶液等体积混合,测得溶液显酸性,则该混合液中: c(CH3COOH)c(CH3COO-);2c(Na+)c(CH3COO-)+c(CH3COOH);
(2)常温下,将0.1mol/L的HCN溶液和0.1mol/L的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液pH7,c(HCN)+c(CN-)0.1mol/L, c(HCN)-c(CN-)2c(OH-)。
请写出下列溶液水解(或双水解)的离子反应方程式:
(1)次氯酸钠溶液:
(2)硫酸铵溶液:
(3)明矾净水原理:
(4)泡沫灭火器工作原理:
(5) 氯化铁溶液与偏铝酸钾溶液混合: