Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X 的质谱图为: |
(1)有机物X的相对分子质量是__________________。 |
| (2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 |
(2)有机物X的分子式是 __________________。 |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3︰1。 |
(3)有机物X的结构简式是 __________________。 |
Ⅱ.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是: ,
, 是由A(C5H6)和B经Diels-Alder反应制得。
是由A(C5H6)和B经Diels-Alder反应制得。
(1)Diels-Alder反应属于 反应(填反应类型):A的结构简式为 。
(2)写出与 互为同分异构体,且一溴代物只有两种的芳香烃的名称: ;写出生成这两种一溴代物所需要的反应试剂和反应条件: 。
互为同分异构体,且一溴代物只有两种的芳香烃的名称: ;写出生成这两种一溴代物所需要的反应试剂和反应条件: 。
工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是。
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。
从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是;然后将滤液,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量(填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有。
③则测定铁矿石中铁的含量的计算式为(用字母表示,不用化简)。
近年来雾霾天气在秋冬季节经常肆虐我国中东部地区。其中,汽车尾气和燃煤是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)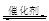 2CO2 (g) +N2 (g)
2CO2 (g) +N2 (g)
在某密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。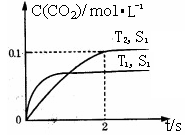
据此判断:
①该反应的平衡常数表达式为。
②该反应的ΔH0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)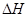 =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g)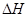 =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过光电转化原理以廉价原料制备新产品的示意图。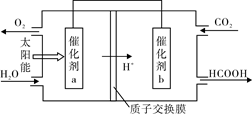
写出上述光电转化过程的化学反应方程式。催化剂a、b之间连接导线上电子流动方向是(填a→b或b→a) 。
K2EO4(E代表某种元素)在工业上有重要的应用,以下是制备该物质的工艺流程图:
已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料。
请回答以下问题:
(1)x的化学式是,H的化学式是。
(2)写出F→G的离子反应方程式。
(3)要工业上实现B→E的转化,y的化学式可能是。
(4)1molH转化为K2EO4时需H2O2的物质的量是。
2014年10月24日,我国探月工程三期再入返回飞行试验器在西昌卫星发射中心由长征三号丙运载火箭发射升空。火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C ="=" K2S + N2 ↑+ 3CO2 ↑。
①写出该反应的氧化剂:;K2S的电子式为 ;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:;
实验二:取黑火药爆炸反应后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊(S)后又变澄清(SO42-)。请设计实验方案证明该澄清溶液中含有Cl-:;
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵(NH4C1O4)、铝粉复合推进剂。高氯酸铵水溶液呈酸性的原因是;(用离子方程式表示)
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮;可燃物有肼(N2H4)、偏二甲肼等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏二甲肼的系统命名为1,1-二甲基联氨,则它的分子式为。
[选修五——基础有机化学]
下图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图.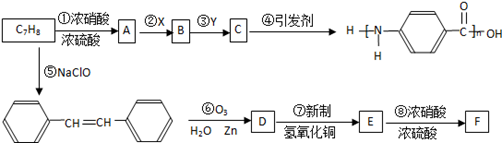
已知:Ⅰ.当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对、间位的氢原子,使新取代基进入它的邻、对位的取代基有-CH3、-NH2等.使新取代基进入它的间位的取代基有-COOH、-NO2等.
Ⅱ.R-CH=CH-R′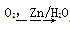 R-CHO+R′-CHO;
R-CHO+R′-CHO;
Ⅲ.氨基(-NH2)易被氧化;硝基(-NO2)可被Fe和盐酸还原成氨基(-NH2).
回答下列问题:
(1)X、Y各是下列选项中的某一项,其中X是________.(填序号)
A.Fe和盐酸 B.酸性KMnO4溶液 C.NaOH溶液
(2)已知B和F互为同分异构体,写出物质F的结构简式:______________________________.
(3)分别写出D、E中的含氧官能团的名称__________________;______________________.
(4)对物质C的下列说法中,正确的是________(填写序号).
A.能发生酯化反应
B.能与溴水发生加成反应
C.只能和碱反应,不能和酸反应
(5)写出反应③、⑦的化学方程式,并注明反应类型
________________________________________________________;__________________.
________________________________________________________;__________________.