(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白: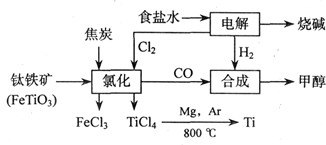
⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应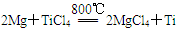 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应:CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。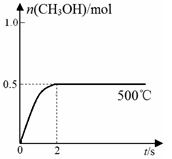
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因
是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: 。
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。(填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
【改编】(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。
【改编】(16分)CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍。具体反应为: ,该正反应的ΔH 0(选填“>”或“=”或“<”)。
,该正反应的ΔH 0(选填“>”或“=”或“<”)。
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g)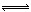 CH3CH2OH(g)+H2O(g)ΔH1
CH3CH2OH(g)+H2O(g)ΔH1
又已知:H2O(l) ="==" H2O(g)ΔH2
CO(g)+H2O(g) 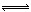 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)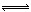 CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(3)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)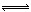 CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有___ 。
A.2v(H2) =" v(CO)"
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应CO(g)+2H2(g)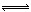 CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
①合成甲醇的反应为__ __(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为__ __L。
④下图中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图。
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是 。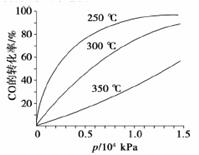
【原创】(共10分)乙烯是一种用途广泛的基本有机化工原料,可以用来合成碳酸二甲酯(DMC)等重要化工产品(部分反应条件已略去):
已知:ⅰ 羟基直接与碳碳双键相连不稳定:R—CH=CH—OH→R—CH2—CHO
ⅱ 1mol化合物C与足量银氨溶液反应生成4mol单质银
(1)工业上生产乙烯的主要方法是 ,试剂X为 。
(2)下列说法正确的是 。
A.D→E的反应类型为取代反应
B.化合物A与化合物C含有相同官能团
C.DMC与乙酸乙酯互为同系物
D.DMC酸性条件下水解能产生CO2和甲醇
(3)写出B→C的化学反应方程式 。
(4)现代工业也常用尿素(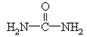 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 。
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 。
MgSO4•7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
回答下列问题:
(1)用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4•7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol/L的盐酸5mL,在不断搅拌下滴加足量2 mol/LBaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。