过氧化钙(CaO2)常用作种子消毒剂、油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。已知某化工厂生产过氧化钙的主要工艺流程如下: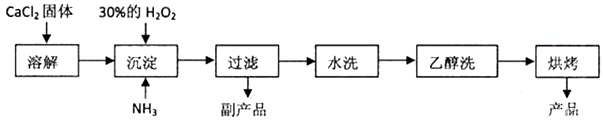
(1)副产品的成分是________,CaCl2固体溶解时,为加快溶解速率,可_________。
(2)在水洗操作中判断沉淀是否洗净的方法是____________________。
(3)用上述方法制取CaO2·8H2O的化学方程式是_____________________。
(4)测定产品中CaO2的含量的实验步骤是:
步骤1:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
步骤2:向上述锥形瓶中加入几滴淀粉溶液。
步骤3:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32-=2I—+ S4O62—】
①上述第三步滴定至终点,现象为__________________
②CaO2的质量分数为______________(用字母表示)
③某同学步骤1和步骤2的操作都很规范,步骤3滴速太慢,这样测得的CaO2的质量分数可能_______(填“不受影响”“偏低”或“偏高”),原因是______________
【2015江苏化学】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g)△H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g)△H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g)△H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见下图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=_______[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
【2015重庆理综化学】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
| A.降低了反应的活化能 | B.增大了反应的速率 |
| C.降低了反应的焓变 | D.增大了反应的平衡常数 |
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
【2015天津理综化学】(14分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。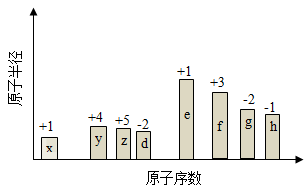
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下: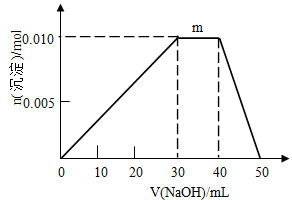
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的离子方程式____________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
【2015四川理综化学】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是_________。
(2)利用价层电子对互斥理论判断TU3的立体构型是______。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是______(填化学式);Z和U的氢化物中沸点较高的是_____(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是_______(填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是_______________________。
【2015安徽理综化学】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| Al_____Si |
N____O |
金刚石_____晶体硅 |
CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。