(1)下列过程中不一定释放能量的是 (请填编号)
A.化合反应
B.分解反应
C.形成化学键
D.燃料燃烧,
E.酸碱中和
F.炸药爆炸
(2)等质量的下列物质分别完全燃烧,放出热量较多的是 (填编号)
A.硫蒸气 B.硫固体
(3)已知:通常条件下,酸碱稀溶液中和生成1mol水放出的热量为中和热。稀溶液中1molH2SO4和NaOH恰好反应时放出QkJ热量,则其中和热为 kJ/mol。
(4)已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ。由此可以推知下列关系正确的是 (填编号)
A、Q1﹥Q3,
B、Q2﹥Q3,
C、2Q1+Q2﹤2Q3,
D、2Q1+Q2﹤4Q3
E、Q1+Q2﹥Q3
F、Q1+Q2﹤Q3
回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
根据上图所示步骤并参考表格数据,回答下列问题。
| 物 质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程方程式:_。
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60 min,其可能原因是。
(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是。
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+ 氧化得到MnO2,反应的离于方程式为。
(6)工业上利用KOH和MnO2为原料制取KMnO4。主要生产过程分两步进行:第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4。
① 第一步反应的化学方程式为。
② 电解K2MnO4的浓溶液时,电解池中阴极的实验现象为。
一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K=;根据下图,升高温度,K值将(填“增大”、“减小”或“不变”)。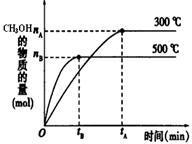
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是(填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)。
a、c(H2)减少
b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加
d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为:。
以A: 为原料,某药物中间体合成路线如下(部分反应条件和产物略)
为原料,某药物中间体合成路线如下(部分反应条件和产物略)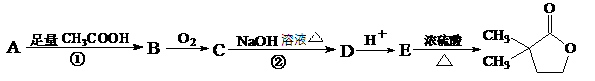
回答下列问题:
(1)1 molA完全燃烧要消耗mol 氧气,若与足量金属钠反应能生成mol氢气。
(2)写出反应①的类型:;D的结构简式:。
(3)写出B→C反应的化学方程式为。
(4)反应①、②的目的是。
(5)写出满足下列条件的A的一种同分异构体的结构简式。
a.不溶于水 b.能发生银镜反应 c.含有 —C(CH3)3
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:_______________________。
硝酸铈铵[(NH4)2Ce(NO3)6]广泛应用于电子、催化工业,其合成路线如下:
(1)已知(NH4)2Ce(NO3)6受热易分解,某科研小组认为反应原理如下,请补充完整:(NH4)2Ce(NO3)6 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。
在空气中加热(NH4)2Ce(NO3)6,除固体颜色有变化外,还可观察到的现象是_________。
(2)步骤Ⅰ中,将Ce(NO3)3·6H2O配成溶液,保持pH到4~5,缓慢加入H2O2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到Ce(OH)4沉淀。该过程中参加反应的氧化剂与还原剂物质的量之比为___________。
(3)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=___________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10—5mol·L-1,需调节pH为______以上。
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2Ce(NO3)6在不同温度、不同浓度硝酸中的溶解度,结果如图。从图中可得出三条主要规律:
① (NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
② _____________________________________________;
③ _____________________________________________。