(15分)【化学—选修化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸: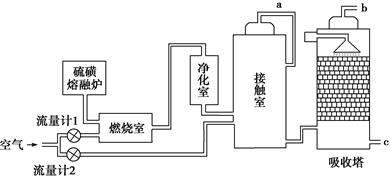
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式______________________________。
Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
(1)焦炭在过程Ⅰ中做剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l)△H1<0
Si(S)+2ZnCl2(l)△H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g)△H2<0
Si(S)+2ZnCl2(g)△H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g)△H3<0
Si(S)+2ZnCl2(g)△H3<0
i. 反应②的平衡常数表达式为。
ii. 对于上述三个反应,下列说明合理的是。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为。
现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为,1molCS2中含有的π键为个。
(3)Y的中心原子的杂化轨道类型为,分子的立体构型为。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为,该氮化钛的化学式为,氮原子的配位数为。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为g.cm3(NA为阿佛加德罗常数值,只列式计算)。
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是。
(2)该配位化合物的化学式为。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为;EDC4常作电镀液,其中DC 的空间构型是,其中D原子的杂化轨道类型是。
的空间构型是,其中D原子的杂化轨道类型是。
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是,其还原产物是。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。

32.该反应的平衡常数表达式为K=。升高温度,其平衡常数(选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为,t5时引起v逆大变化、v正小变化的原因是。
【化学——选修2:化学与技术】
下列问题涉及煤在化工生产中的应用:
(1)煤的转化技术包括煤的气化技术和液化技术。
煤的液化技术又分为和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为;第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、、等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:____________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:__________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是___________________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。