下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
下列反应的离子方程式正确的是
| A.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ |
| B.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O |
| C.碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3·H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如下图所示(部分产物略去),则下列有关物质的推断不正确的是
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA |
B.0.1mol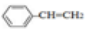 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA |
| C.标准状况下,11.2L乙醇中含有羟基的数目为0.5NA |
| D.4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是
| A.用装置甲氧化废液中的溴化氢 | B.用装置乙分离CCl4层和水层 |
| C.用装置丙分离CCl4和液溴 | D.用仪器丁长期贮存液溴 |
下列有关物质性质和应用正确的是
| A.甲醛能使蛋白质变性,可用于食品防腐剂 |
| B.炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.硅酸钠溶液呈碱性,常用作木材的防火剂 |
| D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |