(1)将0.2mol/LHA(某一元酸)溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则此溶液中c(OH-)_______ c(H+), c(A-)_______c(HA);c(HA)+ c(A-)______0.1mol/L ;此溶液中由水电离出的c(OH-)______0.2mol/LHA溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)将等体积pH=1的盐酸和醋酸,加入适量水,pH都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸 (A为酸根)与某碱
(A为酸根)与某碱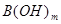 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
在一固定容积的密闭容器中,保持一定条件进行以下反应:X(g)+2Y(g) 3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
(1)在相同实验条件下,若在同一容器中改为加入4molX和6molY,达到平衡后,Z的物质的量为 mol。
(2)在相同实验条件下,若在同一容器中改为加入3molX和2molY,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加 molY, mol Z,才能使平衡时Z为0.6amol。
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) △H =-570kJ/mol ;
② H2(g)+1/2O2(g)=H2O(g) △H =-242kJ/mol ;
③ C(s)+1/2O2(g)="CO" (g) △H =" —110.5kJ/moL" ;
④ C(s)+O2(g)=CO2(g) △H = —393.5kJ/moL;
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) △H = +890kJ/moL
回答下列问题:
(1)上述反应中属于燃烧热的热化学方程式的是 。
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。试写出碳与水蒸气反应的热化学方程式_ ;该反应的熵△S 0 (选填“>”、“=”、“<”);已知自由能△HG可推知该反应在______条件下可自发进行。
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) 按题目的要求写出可能采取的措施。
pC(g)+qD(g) 按题目的要求写出可能采取的措施。
(1)正、逆反应速率都改变,但平衡不移动,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
(2)只改变正反应速率或只改变逆反应速率,则改变的条件可能是单独改变 或是单独改变 。
(3)正、逆反应速率发生不同程度的变化,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
(1)根据图中数据计算反应开始至达到平衡时CO的化学反应速率为v(CO)= ;若升高温度,则化学平衡常数K (填“增大”“减小”或“不变”)。
(2)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应CO(g)+H2O(g)  CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
已知X、Y、Z、Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为 ,X、Y、Z中第一电离能最大的是 。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):

该分子中Y原子的杂化方式是 。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 (填写字母序号)。
| A.该晶体属于分子晶体 | B.此晶体的硬度比金刚石还大 |
| C.晶体的化学式是X3Y4 | D.晶体熔化时破坏共价键 |
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为 。
(5)R的基态原子的电子排布式为 ,R与Z形成的某离子晶体的晶胞结构如下图,则该晶体的化学式为 ,该晶体的密度为a g·cm-3,则晶胞的体积是 cm3(用含a、NA的代数式表示)。