以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
(1)分析上述反应,下列判断正确的是____。
a. 循环过程中产生1 的同时产生
的同时产生
b. 反应①中 还原性比
还原性比 强
强
c. 循环过程中需补充
d. 反应③易在常温下进行
(2)在一定温度下,向2L密闭容器中加入 ,发生反应②.物质的量随时间的变化如图所示。
,发生反应②.物质的量随时间的变化如图所示。 内的平均反应速率
内的平均反应速率
 的转化率=_______
的转化率=_______
(3)恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时, 和
和 充分反应,放出热量的数值比
充分反应,放出热量的数值比 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅( )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)该反应平衡常数的表达式为K=_______.升高温度,其平衡常数_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示
 时引
时引 起突变的原因是_____,
起突变的原因是_____, 引起变化的因素是_____,
引起变化的因素是_____, 时引
时引 小变化、
小变化、 大变化的原因是_________.
大变化的原因是_________.
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是(填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为____________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是_________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是。
【化学与技术】
工业上以氨气为原料制备硝酸的过程如图1所示: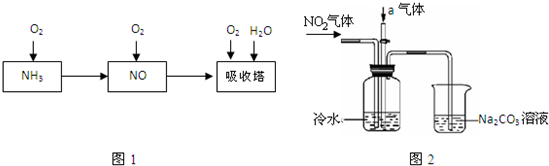
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是;
(2)连接好装置后,首先进行的操作是;
(3)通入a气体的目的是;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K=,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为。
N2O4(g)的平衡常数K=,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为。
【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为;
(2)AB32-的立体构型是,其中A原子的杂化轨道类型是。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为,1molB22+中含有的π键数目为。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为ag/cm3,则晶胞的体积是(只要求列算式,阿伏加德罗常数的值为NA)
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
(注:
和
开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为;滤渣
与稀
反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为。
(2)固体混合物
的组成为;在生成固体
的过程中,需控制
的加入量,若
过量,则因过量引起的反应的离子方程式为。
(3)完成煅烧过程中一个反应的化学方程式:
+
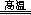 +↑。
+↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0
废料中的铜可完全转化为
,至少需要1.0
•
的
溶液
。
(5)
溶液也可用于制备胆矾,其基本操作是、过滤、洗涤和干燥。
大气中的部分碘源于
对海水中
的氧化。将
持续通入
溶液中进行模拟研究。
(1)
将
氧化成
的过程由3步反应组成:
①
②
③
总反应的化学方程式为,其反应
=。
(2)在溶液中存在化学平衡:
,其平衡常数表达式为。
(3)为探究
对氧化
反应的影响(反应体系如图13),某研究小组测定两组实验中
浓度和体系
,结果见图14和下表。

| 编号 |
反应物 |
反应前 | 反应后 |
| 第1组 |
+
|
5.2 |
11.0 |
| 第2组 |
+
+
|
5.2 |
4.1 |
①第1组实验中,导致反应后
升高的原因是。
②图13中的
为。由
生成
的过程能显著提高
的转化率,原因是。
③第2组实验进行18
后,
下降。导致下降的直接原因有(双选)。
A.
减小 B.
减小 C.
不断生成 D.
增加
(4)据图14,计算3~18
内第2组实验中生成
的平均反应速率(写出计算过程,结果保留两位有效数字)。