工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应,以乙烯为原料制取PVC等产品的转化关系如下图所示 。
。
试回答下列问题:
(1)写出有机物B和G的结构简式:B ,G ;
(2)写出D的所有可能的同分异构体的结构简式 ;
(3)写出④反应的化学方程式 ;
(4)写出⑥反应的化学方程式 ;
反应类型是 ;
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O | B.稀KOH溶液、异丙醇 |
| C.NH4Cl溶液、异丙醇 | D.Fe(NO3)3溶液、异丙醇 |
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
(10)有增长碳链是有机合成中非常重要的反应。例如:
反应①
用 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):
(1)(Ⅰ)的分子式为 ;1mol该物质完全燃烧需要消耗 mol O2.。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(3)(Ⅲ)的结构简式为 ; 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
(4)对二氯苯 也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
【化学---选修3物质结构与性质】15分
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区 I-的最外层电子排布式为
(2)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为。
(3)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。A.CsICl2=CsCl+ICl B.CsICl2 ="CsI" +Cl2
(4)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,
发生化学反应的化学方程式为
(5)ClO2—的空间构型为型,中心氯原子的杂化轨道类型为,
(6)已知CaF2晶体(见图)的密度为ρg/cm3.NA为阿伏加德罗常数,距离最近且相等的两个Ca2+核间距为a cm,则CaF2的摩尔质量为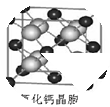
(4分) 一定温度下,A、B两瓶乙酸的浓度分别是1 mol/L和0.1 mol/L,则A、B两瓶乙酸溶液中[ H+ ]之比10(填“<”、“>”或“=”),并简述理由。
用17.4g二氧化锰和足量的浓盐酸充分反应后,列式计算被氧化的HCl的质量是多少?