(共9分)在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________;
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
在一定条件下,可逆反应:mA+nB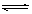 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:
H2(g)+I2(g)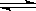 2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
(1)升高温度;
(2)加入催化剂;
(3)充入更多的H2 ;
(4)扩大容器的体积;
(5)保持容器容积不变,通入氖气。
发射卫星用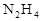 作燃料,
作燃料,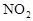 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: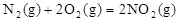 △H1=+67.7kJ/mol
△H1=+67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g)△H2=-534kJ/mol
试写出N2H4与 NO2反应的热化学方程式
。
工业上用电解饱和食盐水的方法制取氢氧化钠、氯气和氢气,但电解前要进行粗盐精制。试回答下列问题:
资料卡片: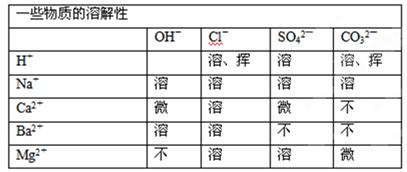
(1)选择试剂以除去下表所列的可溶性杂质。
| 杂质 |
加入的试剂 |
| CaCl2 |
Ⅰ________ |
| MgCl2 |
Ⅱ________ |
| 硫酸盐 |
Ⅲ________ |
(2)精制过程既要将杂质离子Ca2+、Mg2+、SO42— 完全沉淀,又要保证不引入新的杂质,为此你认为加入所选沉淀剂的合理顺序为:Ⅱ、________、________(填序号).
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32—.其中盐酸除去CO32—的化学方程式为______________________________________________________________________.
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是____________。