(共14分)某研究性学习小组设计了一组实验,验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯里分别加入50 mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
①甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性_____________________;
②反应最剧烈的烧杯里金属是_______(填字母)
A、钠 B、镁 C、铝 D、钾;
③写出a烧杯里发生反应的离子方程式 。
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(2)乙同学设计实验验证:非金属元素的非金属性越强,其最高价含氧酸的酸性就越强。他设计了下图装置以验证碳、氮、硅元素的非金属性强弱。乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,其浓溶液在常温下可与铜反应;B是块状固体;烧杯中盛放C的水溶液,打开分液漏斗的活塞后,C中可观察到白色胶状沉淀生成。
①写出所选用物质的化学式:A、 ; C、 。
②写出烧瓶中发生反应的化学方程式: 。
③碳、氮、硅三种元素的非金属性由强到弱顺序为 。
为了讲授“氯气的性质和用途”,李老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了教学.
试回答下列问题:
(1)乙中的现象是____________________,丙中的现象是______________,丁中的现象是______________,分离丁中液体的方法是____________;
(2)橡皮管连通后,分液漏斗的气体压强p1与烧瓶中的气体压强p2的关系为________(填“>”“<”或“=”),连接橡皮管的目的是___________________________________________;
(3)烧瓶内发生反应的离子方程式为___________________________________________
________________________________________________________________________.
用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色突然消失.对产生实验现象的原因有两种推测:①是氯水中的次氯酸的漂白性使它由红色变成无色;②是氯水的酸性(H+)使它由红色变成无色.假设其中一种是正确的.
请你设计一个实验,由实验现象对以上的推测作出判断.
(1)要使用的实验用品:____________________________________________________
________________________________________________________________________;
(2)要进行的实验操作:___________________________________________________
________________________________________________________________________;
(3)实验现象和结论:_____________________________________________________
________________________________________________________________________.
某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
回答下列问题:
(1)该项研究(实验)的主要目的是__________________________________________.
(2)浓硫酸的作用是____________________________________________,与研究目的的直接相关的实验现象是________________________________________.
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故表现是___________,请在图中D框中以图的形式表明克服事故隐患的措施.
某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:_______________________________________________
猜想2:________________________________________________
猜想3:________________________________________________
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则: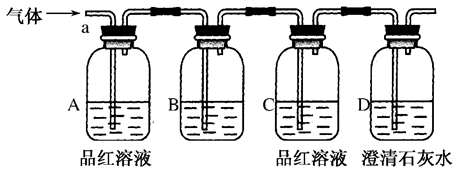
(1)B中应该装下列________试剂(填编号)。
| A.NaCl溶液 | B.酸性KMnO4溶液 |
| C.盐酸 | D.澄清石灰水 |
(2)A中品红溶液的作用是:_________________________________________________。
(3)D中澄清石灰水的作用是:_________________________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色
③D中澄清石灰水变浑浊
【得出结论】
(4)由上述现象该小组同学确认该气体的成分为:________。
某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):
试回答:
(1)上述实验中生成二氧化硫气体的化学反应方程式为
___________________________。
(2)乙同学认为还可能产生氢气的理由是____________________ _____________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是____________________________________________。
(4)B中加入的试剂是________,其作用是___________________ _____________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中________,D中________。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?
答:________,理由是___________________________________