1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
| 元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
| x 值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)通过分析 x 值变化规律,确定N、Mg的 x 值范围:
<x (N)< , <x (Mg)< 。
(2)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(3)经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△ x<1.7时,一般为共价键,试推断AlBr3中化学键类型是 。
(4)预测周期表中,x 值最小的元素位于 周期 族。(放射性元素除外)
(14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g)+2NH3(g) (NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
则A点的逆反应速率V(逆)(CO2)B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H=" +180.6" kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。
(14分,每空2分)四种短周期元素A、B、C、D的性质或结构信息如下。
①原子半径大小:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:
请根据上述信息回答下列问题。
(1)C元素在周期表中的位置, 请写出D2C2分子的结构式________,A元素的单质与物质甲发生反应的离子方程式_______。
(2)丁物质与乙互为同系物,在相同条件下其蒸气的密度是氢气密度的36倍,且核磁共振氢谱只有
1组峰,写出丁物质的结构简式。
(3)A与同周期的E元素组成的化合物EA5在热水中完全水解生成一种中强酸和一种强酸,该反应的化学方程式是。
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式,一段时间后,测得铁增重128g,此时b极通入气体的体积是L(标准状况下)。
【化学—化学与技术】
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下: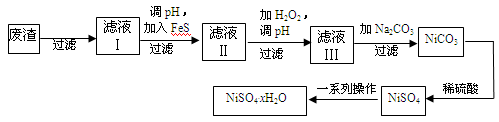
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是,调pH的目的是。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是。
铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为:,某同学实验时却有黑色物质出现,这种黑色物质的化学式为:。
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2++4I- =2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I- =2CuCl↓(白色)+I2。
为顺利观察到白色沉淀可以加入的最佳试剂是。
| A.SO2 | B.苯 | C.NaOH溶液 | D.乙醇 |
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式:。
②写出CuH在过量稀盐酸中有气体生成的离子方程式。
③将CuH溶解在适量的稀硝酸中, 完成下列化学方程式
(4)常温下,向0.20 mol • L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=________________mol.L‑1。
[已知:
 ]
]
I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度B.加水稀释
C.加少量的CH3COONa固体D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。