(12分) A、B、C、D是由短周期元素形成的单质。B、E均为组成空气的成分。化合物F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):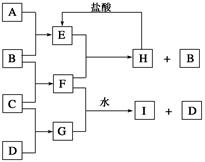
请填写下列空白:
(1)E的结构式 ,F的电子式 。
(2)A元素的一种核素用于考古,写出该核素符号________________。
(3)F与水反应的化学方程式是____________________________________________。
(4)F与G的水溶液反应生成I和D的离子方程式是________________________________。
(5)1.7g D的气态氢化物完全燃烧放热6.8kJ,写出表示该气态氢化物燃烧热的热化学方程式_____。
尼龙是目前世界上产量最大、应用范围最广、性能比较优异的一种合成纤维。以X为原料合成高分子化合物尼龙-66的流程如下:
已知部分信息如下:
I.Z的化学式为C6H10O4。
Ⅱ.X和浓溴水反应产生白色沉淀。
Ⅲ.某些醛与醛之间能发生羟醛缩合反应,例如:
请回答下列问题:
(1)X的化学名称为____ __,W的结构简式为__________,T的分子式为 _____________。
(2)反应②的条件为______________________。
(3)上述反应中属于加成反应的有 。
(4)写出反应④的化学方程式________________________。
(5)满足下列条件的S的同分异构体的结构共有________种(不考虑立体异构),①单环芳香族化合物 ②既能发生银镜反应,又能发生水解反应其中,苯环上核磁共振氢谱上有2个峰的结构简式为_________________。
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)I中所含化学键类型_______________,
(2)G的水溶液呈酸性,用离子方程式表示其原因_______________________
(3)实验室制备气体C的化学方程式___________________________
(4)已知含7.4gI的稀溶液与200mL1mol/L的H溶液反应放出11.56kJ的热量,写出该反应的热化学方程式_________________________________
(5)物质A由三种元素组成,1 mol A与水反应可生成1 mol B和2 mol C,A化学式为_______________。
[化学—选修5,有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下: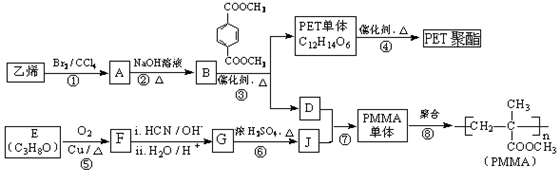
已知:
Ⅰ.RCOOR’+ R’’18OH RCO18OR’’+R’OH(R、R’、R’’代表烃基)
RCO18OR’’+R’OH(R、R’、R’’代表烃基)
|
Ⅱ. (R、R’代表烃基)
(R、R’代表烃基)
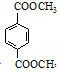 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
Ⅲ.向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成
Ⅳ.向Ⅱ中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验Ⅱ中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH- AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
(1)该溶液中一定含有的阳离子是_____________,其对应物质的量浓度之比为____________,溶液中一定不存在的阴离子是____________________。
(2)请写出沉淀减少的离子方程式________________________。
X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)向FeCl2溶液中加入X的水溶液,是溶液颜色变为棕黄色的微粒是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是 。
(2)若用下列装置只进行Z + W X + Y反应(夹持装置未画出):
X + Y反应(夹持装置未画出):
①完成此实验有多步操作,其中三步是:a.点燃酒精灯,b.滴加盐酸,c.检验气体纯度
这三步操作的先后顺序是 (填字母)。
②为保证实验成功,上述装置需要改进,方法是(用文字叙述) 。
(3)将3.48 g Z加入50 mL 4 mol/L的稀HNO3中充分反应,产生112 mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀。当沉淀量最多时,至少需要加入2 mol/L的NaOH溶液 mL(精确到0.1)。