镁是生产铝合金必需的添加材料。镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域。现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示。在下列因素中对产生H2速率有影响的是
| A.镁条的质量 | B.镁条的表面积 |
| C.Cl-的浓度 | D.压强 |
下列说法不正确的是( )
A.Na2CO3溶液中c(OH-)大于c(HCO)
B.水的离子积常数为KW,若溶液中c2(OH-)=KW,溶液pH可能小于7
C.1 mol/L的CH3COOH溶液加水稀释时,溶液中某种离子浓度可能增大
D在CH3COOH溶液中加入溶于水溶液呈碱性的固体物质,平衡一定向电离方向移动
下列解释实验事实的方程式不正确的是( )
| A.0.1 mol/L CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ |
| B.“NO2球”浸泡在冷水中,颜色变浅:?;ΔH<0 |
| C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO===3Fe2++2NO↑+4H2O |
| D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO+H2O?HCO+OH- |
某密闭容器中充入等物质的量的气体A和B,在一定压强和温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确的是( ) 
| A.30 min时降低温度,40 min时升高温度 |
| B. 0~8 min内A的平均反应速率为0.08 mol·L-1·min-1 |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D. 54 min时C的体积分数大于40 min时 |
A、B混合气体在密闭容器中发生如下反应:
 ,达到化学平衡后测得A气体的浓度为
,达到化学平衡后测得A气体的浓度为 ;当恒温下将密闭容器的容积扩大一倍并再次达到平衡时,测得A气体的浓度为
;当恒温下将密闭容器的容积扩大一倍并再次达到平衡时,测得A气体的浓度为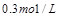 。则下列叙述正确的是()
。则下列叙述正确的是()
A.平衡向右移动B.
C.B的转化率提高D.C的体积分数增加
在一定温度下,反应 的平衡常数为10。若将
的平衡常数为10。若将 的
的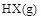 通人体积为1.0
通人体积为1.0  的密闭容器中,在该温度时的
的密闭容器中,在该温度时的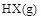 最大分解率接近于()
最大分解率接近于()
| A.5% | B.17% | C.25% | D.33% |