为证明化学反应有一定的限度,进行如下探究活动: I.取5m1 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+) Ⅱ.继续加入2ml CCl4振荡. Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为 ;
探究活动Ⅱ的实验现象为 。
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 |
现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] |
若产生① , 则② 不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 |
若③ , 则④ 成立; |
ⅱ.写出实验操作“步骤一”中反应的离子方程式为 。
常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量。查阅资料得知:
一种常用的分析试剂 EDTA二钠盐(用Na2H2Y•2H2O表示)可用于测定Ca2+,其反应为:
Ca2++H2Y2-===CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色。于是该实验小组做了如下实验:
步骤一:配制待测溶液。取适量补钙片研碎后,准确称取0.400 g配成250 mL溶液。
步骤二:滴定。用移液管取待测液25.00 mL于锥形瓶中,加入适量NaOH溶液,摇
匀,再加入铬黑T指示剂3滴,用0.0100 mol•L−1EDTA二钠盐溶液滴定至终点。
三次重复滴定平均消耗EDTA二钠盐溶液22.50 mL。
请回答下列问题:
(1)步骤一中补钙剂要用2 mol/L的盐酸溶解,反应的离子方程式为__________________,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有_______、________,操作的先后顺序为:e→____→____→d→f→____→____→____(填下列操作的序号)。
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为_______。
(3)下列操作会导致测定结果偏高的是_______(填下列选项的字母序号)。
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式____________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二: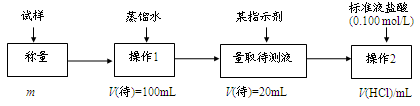
方法三: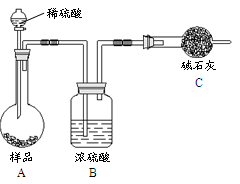
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3— 离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和干燥(烘干);
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择甲基橙指示剂.
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
按图所示装置进行铁和水蒸气反应的实验。
(1)写出试管A中发生反应的化学方程式:____________________,__________________。
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示) ____________。描述能证明气体产物的实验现象:_______________________。
____________。描述能证明气体产物的实验现象:_______________________。
(3)反应停止,待试管A冷却后,取少量其中的固体物质,加入过量的稀盐酸充分反应后,进行如下实验:
①试剂X的化学式为__________________。
②用离子方程式和必要文字表示加入新制氯水后溶液红色加深的原因:_____________________。
③若在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色的原因进行探究。
I.提出假设:
假设1:溶液中的 被氧化。
被氧化。
假设2:溶液中的Fe3+被氧化。
假设3:___________________________。
___________________________________。
II.设计方案:请对所提出的假设2进行验证,写出实验方案。
____________________________________。
III.方案实施。
以下是有关 的性质实验。
的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究 的性质。
的性质。
①若从左端分别通入 ,装置A中观察到的现象_________(填“相同”或“不相同”);若装置D中装的
,装置A中观察到的现象_________(填“相同”或“不相同”);若装置D中装的 (催化剂),通入
(催化剂),通入 时,打开K通入适量
时,打开K通入适量 的化学反应方程式为_______________________。
的化学反应方程式为_______________________。
② 通入B中,溶液颜色褪去,则该反应的离子方程式为____________________。
通入B中,溶液颜色褪去,则该反应的离子方程式为____________________。
(2)某同学将足量的 通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量__________(填字母),能产生白色沉淀。
通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量__________(填字母),能产生白色沉淀。
| A.氨水 | B.稀盐酸 | C.硝酸钾溶液 | D.硫化钠溶液 |
(3)若由元素S和O组成 价酸根离子X,X中S和O的质量比为2:3;当
价酸根离子X,X中S和O的质量比为2:3;当 与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出
与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出 与含X的溶液反应的离子方程式:________________。
与含X的溶液反应的离子方程式:________________。
(4)某科研单位利用电化学原理用 来制备硫酸,装置如右图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入
来制备硫酸,装置如右图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入 的电极为________________极,其电极反应式为______________________;电池的总反应式为____________________。
的电极为________________极,其电极反应式为______________________;电池的总反应式为____________________。