对于结构简式为下图的烃,下列说法正确的是
| A.分子中至少有6个碳原子处于同一平面上 |
| B.分子中至少有8个碳原子处于同一平面上 |
| C.分子中至少有10个碳原子处于同一平面上 |
| D.分子中至少有14个碳原子处于同一平面上 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应 X(g)+Y(g)  2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
下列生产或实验事实引出的相应结论不正确的是
| 事实 |
结论 |
|
| A |
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 |
当其他条件不变时,升高反应温度,化学反应速率加快 |
| B |
工业合成氨中,将氨气液化分离 |
可以加快反应速率,提高N2、H2的转化率 |
| C |
FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体 溶液颜色加深 Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体 溶液颜色加深 |
恒温时增大反应物浓度,平衡向正反应方向移动 |
| D |
A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 |
当其他条件不变时,催化剂可以改变化学反应速率 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl—KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列有关说法正确的是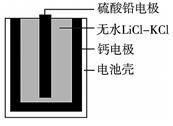
| A.正极反应式:Ca+2Cl--2e-===CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.每转移0.1 mol电子,理论上生成20.7 g Pb |
| D.常温时,在正负极间接上电流表或检流计,指针不偏转 |
常温下,1 mol化学键断裂成气态原子所需消耗的能量用E表示。结合表中信息判断下列说法不正确的是
| 共价键 |
H—H |
F—F |
H—F |
H—Cl |
H—I |
| E(kJ·mol-1) |
436 |
157 |
568 |
432 |
298 |
A.432 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g)="==2HF(g)" ΔH=-25 kJ·mol-1