下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是 (填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 。
(3)C催化氧化生成D的化学方程式为 。
(4)有机物B具有的性质是 (填序号)。
①无色无味的液体;
②有毒;
③不溶于水;
④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是 (用化学方程式说明) 。
在6份0.01mol/L氨水中分别加入下列各物质:
| A.浓氨水 | B.纯水 | C.少量浓H2SO4 | D.少量NaOH固体 E.少量Al2(SO4)3固体 |
(1)能使[OH—]减小、[NH4+]增大的是_______
(2)能使[OH—]增大、[NH4+]减小的是_______
(3)能使[OH—]和[NH4+]都增大的是_________
(4)能使[OH—]和[NH4+]都减小的是_________
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l) = H2O(g)ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点.
某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=_________;
(2)若所得混合溶液pH=2,则a:b=__________。
下图表示的是N2 + 3H2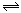 2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率)
2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率) 
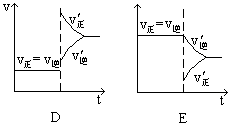
(1)表示减少H2的量而建立新平衡的是。
(2)表示压缩气体, 体积减小而建立新平衡的是。
(3)表示降低温度而建立新平衡的是。
(4)表示升高温度而建立新平衡的是。
(5)表示加入催化剂后而建立新平衡的是。
已知电子工业上常用FeCl3溶液来溶解电路板中的铜。某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe。完成下列问题:
(1)该反应中的还原产物的化学式是,氧化产物的化学式是。
(2)该反应中,发生还原反应的过程是(填化学式)→。
(3)该反应的离子方程式为:。
(4)标出该反应电子转移的方向和数目
(5)如反应转移了0.3mol电子,则(填“溶解”或“生成”)的铁的质量为。