工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为 ;
②硫酸钠和焦炭、石灰石反应的化学方程式为_ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行? 。
(4)某工厂用氨制硝酸,再进一步制NH4NO3。已知由NH3制HNO3时产率为88%,由NH3被HNO3的吸收率为98%。则该工厂用100吨氨最多能制硝酸铵 吨(计算结果保留整数)。
配平下列氧化还原反应方程式
Cu2++FeS2+ ====Cu2S+
====Cu2S+ +Fe2++
+Fe2++
配平□P4O+□Cl2——□POCl3+□P2Cl5。
配平方程式:
□SO2+□H2S——□S+□H2S
一个体重50 kg的健康人含铁2 g。这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子(亚铁离子)易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可以使食物中的铁离子(三价铁离子)变成亚铁离子,有利于铁的吸收。
(1)人体中经常进行Fe2+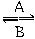 Fe3+的转化,A中Fe2+作_________剂,B中Fe3+作_______剂。
Fe3+的转化,A中Fe2+作_________剂,B中Fe3+作_______剂。
(2)从“服用维生素C,可以使食物中的铁离子变成亚铁离子”这句话分析出维生素C在这一反应中作______________剂,具有_________________性。
已知下列3个反应:
16HCl(浓)+2KMnO4====2KCl+2MnCl2+8H2O+5Cl2↑ ①
4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑ ②
MnCl2+2H2O+Cl2↑ ②
4HCl(浓)+O2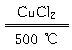 2H2O+2Cl2↑ ③
2H2O+2Cl2↑ ③
试完成下列问题:
(1)3个反应中的还原剂___________________(选填字母)。
| A.都是浓盐酸 | B.都是HCl |
| C.只有2个反应是HCl | D.只有1个反应是HCl(aq) |
(2)KMnO4、MnO2、O2的氧化性强弱顺序为_______________________。