A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)A与C按原子个数比为1:1形成化合物的电子式是 。
(2)C、E所形成氢化物的稳定性由强到弱的顺序是 > (填具体的化学式)。
(3)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池工作时的化学反应方程式: ;放电时溶液中移向正极的离子有: 。
(4)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和C与A形成的一种化合物反应的离子方程式: 。
常温下,10 mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示。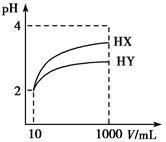
请回答下列问题:
(1)在图中用曲线表示将10 mL pH=2的盐酸加水稀释到1000 mL的过程中溶液pH变化趋势。
(2)物质的量浓度均为0.1 mol·L-1的NaX和NaY溶液,pH较小的是________,其中水的电离程度较大的是________。
(3)常温下,0.1 mol· L-1的HY溶液中加入等体积pH=1的盐酸后,溶液的pH_______(填“升高”或“降低”),HY的电离程度________(填“增大”、“减小”或“不变”)。
(4)H2Z是一种二元弱酸,常温下,0.1 mol·L-1的H2Z溶液中加入等体积pH=13的KOH溶液后,溶液的pH<7,原因可能是__________________________。
H3PO2是一元中强酸,写出其电离方程式_______________________。
NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”、“中性”或“弱碱性”)。
(2)下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| 冷轧含锌 废水水质 |
经处理后的水国 家环保标准值 |
|
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
| SO42-浓度/(mg·L-1) |
≤23 000 |
≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为________mg·L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),________(填“符合”或“不符合”)国家环保标准。
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
| 0.01 mol·L-1的溶液 |
X |
Y |
Z |
W |
| pH |
12 |
2 |
8.5 |
4.5 |
(1)X、W的化学式分别为________、________。
(2)W在溶液中的电离方程式为__________________________。
(3)25 ℃时,Z溶液的pH>7的原因是___________________(用离子方程式表示)。
(4)将X、Y、Z各1 mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为_______________________________。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为________________。
已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1 mol产物的数据)。
(1)写出表示S8燃烧热的热化学方程式_______________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式________________________。
(3)化学上规定,拆开或形成1 mol化学键吸收或放出的能量称为该化学键的键能,单位kJ·mol-1。若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为______________。
芒硝化学式Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为_______________。此时通过阴离子交换膜的离子数_______________(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的氢氧化钠溶液从出口_______________(填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________。
(4)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为_______________。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有_______________kJ的能量转化为电能。