小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加.
[知识回放]
金属活动性顺序:K Ca Na Mg Al Zn ________ Sn Pb (H) ________ Hg Ag Pt Au,请你在横线上填写对应金属的元素符号.
[作出猜想]
猜想1.Cr>Fe>Cu;
猜想2.Fe>Cu>Cr;
猜想3.你的猜想是________.
[查阅资料]
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
[设计与实验]
小聪同学取形状大小相同的三种金属片,用砂纸打磨光亮,分别放入三支洁净试管中,再向三支试管中分别加入等量的同种稀硫酸.
| 实验 |
试管1 |
试管2 |
试管3 |
| 实验操作 |
 |
 |
 |
| 实验现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 |
铬片表面产生气泡较快,溶液变成为蓝色 |
________ |
[结论与解释]
(1)小聪得到的结论是猜想________正确.
(2)实验前用砂纸打磨金属片的目的是________________________.
[知识运用]
将铬片投入FeSO4溶液中,反应________(填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式________________________.
暖宝宝是一种防寒用品,如图所示。暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步验证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引;炭粉、二氧化锰不与稀硫酸反应;氧化铜与稀硫酸反应后溶液呈蓝色。
【得出结论】该黑色粉末可能含有(写物质的名称)。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取黑色粉末加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液无蓝色 |
| ② |
取实验①的残渣灼烧,将内壁涂 有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由实验①可知,该黑色粉末中肯定含_____________,肯定不含______________。
由实验②可知,该黑色粉末肯定含。
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量。由此可见,
人们可以利用化学反应放出的能量,请再举一例:___________________。
(3)人们利用化学反应还可以_______________________。
(4)课外小组的同学研究的课题是测定贝壳中碳酸钙的质量分数,他们取25g贝壳粉碎后放入烧杯中,向杯中倒入稀盐酸,当倒入100g稀盐酸后发现不再产生气泡,并测得烧杯内固体和液体总质量为120.6g (杂质不反应)。求贝壳中碳酸钙的质量分数。
某化学兴趣小组的同学按照课本上的实验装置做“测定空气中氧气的体积分数”实验(如图所示),但测出的氧气的体积分数明显小于1/5。请你参与探究: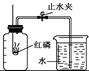
(1)提出问题:造成误差的原因是什么?如何改进课本上的实验装置?
(2)查阅资料:红磷、白磷的一些性质如下表:
| 颜色、状态 |
熔点/℃ |
着火点/℃ |
密度/(g/cm3) |
|
| 红磷 |
暗红色固体 |
590 |
240 |
2.34 |
| 白磷 |
白色或黄色固体 |
44.1 |
40 |
1.82 |
(3)猜想与假设:
①甲同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性。
②乙同学:可能是瓶内残留气体中还有氧气。
③你还能作出的猜想是。
(4)交流与讨论:
①丙同学认为用木炭代替红磷,就可以消除误差,你认为他的猜想,(填“合理”或“不合理”)理由是。
②他们对课本上的实验装置进行了图2所示的改进(其他仪器忽略)。
a.甲同学提出应把红磷换为白磷,理由是_______________。
b.通过粗铜丝来点燃玻璃管内的白磷,这利用了金属的性。
c.与课本上的实验装置相比较,该装置的一个优点是_________________________________.
(5)探究与反思:
①为了验证乙同学的猜想,将铜粉放在残余气体中加热,观察到铜粉变黑色,证明乙同学的猜想(填“合理”或“不合理”)
②大家用改进的实验装置(如图所示)进行实验,待玻璃管冷却、管内白色的烟幕消失时,左玻璃管内的液面上升了1格,得到了较准确的结果,但又意外发现左玻璃管内壁上端附着黄色固体。左玻璃管上端的黄色固体的主要成分可能是。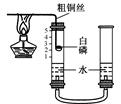
小明同学在一本化学资料中发现KClO3晶体在MnO2的催化下,能分解生成O2和氯化钾,于是提出疑问,CuO能催化KClO3的受热分解反应吗?于是设计了以下实验:
[实验方案] ①任取2份氯酸钾,分别放于两支试管中,仅向其中一支试管中加入m克CuO; ②将上述盛有KClO3的两支试管,在相同条件下同时加热,并使产生的气体通入水中,观察产生气泡的速率 , 比较产生气体的速率;③充分反应后冷却,将放入CuO的试管内固体残余物加水溶解,滤出不溶物,洗涤并干燥; ④观察滤出固体物质的颜色状态为黑色固体。 ⑤将滤出固体与碳粉混合后,在密闭容器中加热,将所产生的气体通过澄清石灰水,观察现象黑色固体变为红色,石灰水变浑浊 。
[交流讨论] (1)步骤:①②的目的是通过对比实验,探究
在第三步过滤操作中用到的玻璃仪器为、 、
(3)步骤⑤的目的是证明
(4)小红认为小明实验中有缺陷,请你帮小红改进实验中的不足之处: 、
下图所示为实验室常用的实验装置: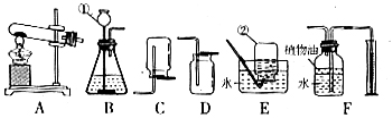
据此回答下列问题:(1)写出带标号仪器的名称:
①②
常温下,用锌和稀硫酸反应制取氢气,应选用的发生装置是
(填序号,下同),收集装置是
(3)实验室通常用稀盐酸和石灰石反应制取CO2,该反应的化学方程式为,检验CO2的化学方程式此外CO2也可以用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为若用此法来制取CO2,应选用的发生装置是,收集装置是
(4)F装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是,植物油上方原有的空气对实验的结果(填“有”或“没有”)明显影响。
某同学为了研究竹子里面气体的成分,做了一个实验:
(1)他先将竹子浸在水里,钻一小孔,看到一串串气泡冒出,然后采用法收集到了甲乙两瓶气体;
(2)将放有足量红磷的燃烧匙伸入甲瓶中(如图)。用放大镜聚焦,使红磷燃烧,瓶内充满了白烟。然后,将该瓶倒放水中,松开夹子,结果流入的水约占瓶子容积的1/10,说明竹子里气体中肯定含有。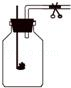
(3)再往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊,说明竹子气体里肯定有。
(4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重做了上述两个实验.相比较后得出的结论是。