图是氯化钠和硝酸钾两种固体物质的溶解度曲线.
某兴趣小组为了研究NaCl和KNO3的溶解和结晶,做了两组实验(室温下),其过程如下:
[第一组]
[第二组]
(1)①中溶质的质量分数为________________,⑨的现象是________________.
(2)第一组实验中操作a为________,所得氯化钠固体质量增多可能是下列原因中的(填字母序号)________.
| A.溶解NaCl固体时,没有用玻璃棒搅拌 |
| B.称量5g NaCl固体后,称量纸上仍留有固体 |
| C.蒸发时,未及时停止加热,有固体溅出 |
| D.蒸发后所得NaCl固体中仍含有水分 |
(3)上述实验过程中一定属于饱和溶液的是(填数字序号,下同)________,溶质与溶剂质量比一定相等的是________.
某化学兴趣小组的同学参照教科书内容,在学校实验室里完成了以下两个实验:
实验一:配制溶质质量分数为6%的NaCl溶液50 g,按如下步骤进行操作: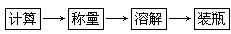
实验二:称取5.0 g粗盐进行提纯。粗盐除含有NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示: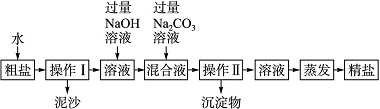
请你根据以上信息回答下述问题:
(1)配制50 g溶质质量分数为6%的NaCl溶液,需NaCl______g,水______mL。
(2)NaCl溶解过程中用到了玻璃棒,它的作用是________________。
(3)粗盐提纯时,操作Ⅰ的名称为__________________。
(4)某同学所得精盐比其他同学明显要少,原因可能是____________________。
A.溶解时将5.0 g粗盐一次全部倒入水中,立即过滤
B.蒸发时有一些液体、固体溅出
C.提纯后所得精盐尚未完全干燥
为维护食品安全,卫生部公告自2011年5月1日起,禁止在面粉生产中添加增白剂及过氧化钙等.
(1)过氧化钙的化学式为CaO2,其中氧元素与钙元素的质量比为.
(2)正确看待和安全使用食品添加剂非常重要.下图是超市售卖的2种不同品牌橙汁的标签.
①2种橙汁均属于(填“纯净物”和“混合物”).
②你更倾向于选择的品牌是:(填“A”或“B”)为防范添加剂危害,选购包装食品时应(至少一条).
(5)(3分)过氧化钙在养鱼时可用作增氧剂,多少克过氧化钙(CaO2)和49克氯酸钾(KClO3)中含氧元素的质量相等?(写出计算过程)
阅读材料,回答问题。
材料I氯气(Cl2)在通常情况下为黄绿色有毒气体。
材料Ⅱ Cl2化学性质很活泼,具有较强的氧化性,能与多种金属和非金属直接化合。氢气和氯气的混合气点燃或强光照射时发生爆炸。
材料Ⅲ Cl2可用于制备多种消毒剂,含氯元素的消毒剂有ClO2、NaClO、Ca(ClO)2等。
(1)实验室闻氯气的正确操作是。
(2)氢气和氯气生成氯化氢气体的反应从能量变化(“吸热反应”或“放热反应”)和基本反应类型角度分类,分别属于、。
(3)下列说法错误的是(选填字母序号)
A燃烧一定包含着化学变化
B燃烧不一定要有氧气参加
C物质与氧气发生的反应都属于氧化反应
D爆炸一定是可燃物与氧气发生的发光、放热的剧烈的氧化反应
(15分)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验。
一、铁红制备的流程图分析
(1)写出焙烧中CO与Fe203反应的化学方程式_。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和_(填仪器名称)
(3)你认为对气体C最佳的处理方法是_。
A.冷却后排入空气 B.燃烧后排放 C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是_。
(5)反应2中相关物质的溶解度如下表。你认为该反应在常温下能实现的原因是。
洗涤干燥得到K2S04晶体时,可选用下列__(填字母)洗涤剂;
A.KCl的饱和溶液 B.水 C.K2S04的饱和溶液
为检验K2S04晶体是否洗涤干净,可取最后一次洗涤液,先加入_(选填序号,下同),
振荡、静置,再向上层清液中滴加_,观察现象即可判断。
A.AgN03溶液 B.过量的BaCl2溶液 C.过量的Ba(N03)2溶液
二、铁红的性质实验
【问题讨论】
【资料1】草酸晶体(H2C204·3H20)在浓H2S04作用下受热分解,化学方程式为:
H2C2O4·3H2O C02↑+C0↑+4H20
(6)实验前应先_。
(7)进入E中的气体是纯净、干燥的CO,则B、D中的试剂依次是__、___(填字母编号)。
A.浓硫酸 B.澄清的石灰水 C.氢氧化钠溶液
(8)C装置的作用是。
【数据分析与计算】
用SDTQ600热分析仪对氧化铁(Fe2O3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如下图。
【资料2】已知铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁。
(9)800℃以上时,管内固体成分的化学式为;
(10)写出管内固体质量由48g变为46.4g时反应的化学方程式_。
【实验评价】
请指出【问题讨论】中实验装置的一个明显缺陷。
活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品。用粗ZnO制备活性ZnO的生产工艺流程做如下图所示。
I制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:
【查阅资料】
1、粗ZnO中常含杂质FeO、CuO
2、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
3、已知:几种物质沉淀时的pH如下表:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
| 完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 |
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是______________________ 。
(2)写出ZnO与加稀硫酸反应的化学方程式。
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是,操作A的名称是。
(4)反应2中加入锌发生的反应属于反应(填化学反应的基本类型)。
Ⅱ测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3•yZn(OH)2•zH2O,用下列装置测定碱式碳酸锌的化学组成。(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2三种产物,其中
ZnCO3 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2 ZnO+H2O
ZnO+H2O
【实验步骤】
①按图连接好装置,并检查装置的;
②在热分解装置中装入68.2g样品,打开活塞,关闭,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如下数据:
| 装置C的质量(/g) |
装置D的质量(/g) |
|
| 实验前 |
198.4 |
235.7 |
| 实验后 |
209.2 |
244.5 |
【实验分析及数据处理】
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是。
(2)第⑤步继续通空气的目的是。
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量(填“偏大”、“偏小”或“无影响”)。
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=
该碱式碳酸锌受热分解的化学方程式为。