[化学——选修3:物质结构与性质]原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T位于周期表的ds区,且最外层只有一个电子。
(1)Y原子核外共有 种不同运动状态的电子,T原子的价层电子排布式 。
(2)由X、Y、Z形成的离子ZXY -与XZ2互为等电子体,则ZXY -中X原子的杂化轨道类型为 。
(3)Z与R能形成化合物甲,1mol甲中含 mol共价键,甲与氢氟酸反应,生成物的分子空间构型分别为 。
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为 。
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为 。
(6)T和Y形成的晶体的晶胞结构如图所示,Y离子的配位数是 。设晶胞棱长为a cm,密度为b g.cm-3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
(8分)氨的合成是最重要的化工生产之一。
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示: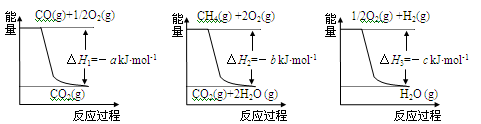
则△H4=______________(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
| 达到平衡的时间(min) |
t |
5 |
| 平衡时N2的浓度(mol·L-1) |
3 |
c |
①甲容器达到平衡所需要的时间t5min(填“>”、“<” 或“=”,下同);乙容器达到平衡时N2的浓度c3 mol·L-1。
②下图中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和 H2平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图。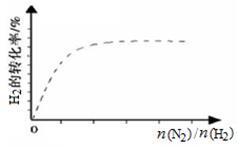
(8分)碳的化合物与人类生产、生活密切相关。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表。
| T/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
1 |
0.8 |
0.65 |
0.6 |
0.6 |
| n(CO)/mol |
0.8 |
0.6 |
0.45 |
0.4 |
0.4 |
则该温度下反应的平衡常数K=________。
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2 molH2,此时v(正)=v(逆),则x、y的关系式是________________。
II.在一恒温、恒容密闭容器中发生反应:
Ni(s)+4CO(g) Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
(8分)已知下表为25℃时某些弱酸的电离平衡常数;下图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化。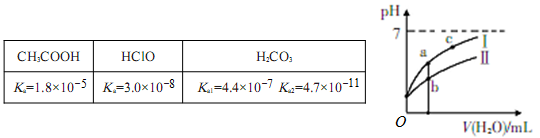
(1)图像中,曲线Ⅰ表示的酸是_____(填化学式);起始时,c(CH3COOH)_______c(HClO)(填“>”、“<”、“=”)。
(2)a、b、c三点中,水的电离程度由大到小的顺序是___________(用编号表示)。
(3)25℃时,NaClO溶液的水解平衡常数Kh=_______________。
(4)向NaClO溶液中通入少量CO2的离子方程式为____________________。
(9分)将反应IO3-+5I-+6H+ 3I2+3H2O设计成如图所示的原电池。
3I2+3H2O设计成如图所示的原电池。
(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,此时甲池中发生的电极反应式为____________,工作过程中关于电流计的读数,下列说法正确的是_______(填编号)
a.电流计读数逐渐减小b.电流计读数有可能变为0
c.电流计读数一直不变d.电流计的读数逐渐增大
(2)如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,则溶液变蓝的烧杯是_______(填“甲”、“乙”)。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时乙池中发生的电极反应式为____________,电流计指针向_____(填“左”、“右”)偏转。
(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g)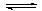 pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。