冰晶石是一种矿物,主要成分为六氟合铝酸钠(Na3AlF6),微溶于水,熔融的冰晶石能溶解氧化铝,在电解铝工业作助熔剂,制造乳白色玻璃和搪瓷的遮光剂。工业上生产Na3AlF6的主要流程如下: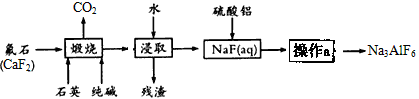
试结合生产流程回答下列问题:
(1)浸取后的“残渣”中一定含有的成分是________,硫酸铝与NaF(aq)反应的离子方程式为____;
(2)为提高NaF的浸出率,煅烧后的固体在浸取前应采取的措施为 ,为得到纯净的Na3AlF6产品,操作a包括的主要操作步骤为 → → ;
(3)在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF(aq)的pH下调至5左右,请解释其原因是 ;
(4)78kg含CaF280%的氟石(杂质不含氟元素)理论上可生产Na3AlF6______kg(设生产过程中的每一步含氟物质均完全转化);
(5)碳酸化法也是工业制取Na3AlF6的一种方法:在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳即可,请写出该反应的化学方程式_____________。
FeSO4•7H2O广泛用于医药和工业领域。
以下是FeSO4•7H2O的实验室制备流程图。根据题意完成下列填空: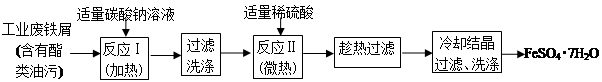
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是 。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答) , 。
(3)判断反应Ⅱ完成的现象是: , 。
以下是测定某补血剂(FeSO4•7H2O)中铁元素含量的流程图。根据题意完成下列填空:
|
 (4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。
(4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。
(15分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是______________,发生反应的化学方程式是_____________。
(2)B中加入的物质是________,其作用是。
(3)实验时在C中观察到的现象是__________________________,发生反应的化学方程式是____________________。
(4)实验时在D中观察到的现象是________,D中收集到的物质是________,检验该物质的方法和现象是________________________。
某同学按下列步骤配制500mL 0.2mol·L-1 Na2SO4溶液,填空并回答有关问题。
| 实验步骤 |
有关问题 |
| ①计算所需Na2SO4的质量 |
需要称量Na2SO4的质量为克 |
| ②称量Na2SO4固体 |
|
| ③将Na2SO4加入100mL烧杯中,并加入适量水溶解 |
|
| ④将烧杯中溶液转移至500mL容量瓶中 |
为了防止溶液溅出,应采取什么措施: |
| ⑤向容量瓶中加蒸馏水至刻度线 |
在进行此操作时当加水至刻度线1—2厘米处应如何操作: |
| ⑥摇匀 |
(1)上述实验步骤中缺一会严重影响溶液浓度的重要步骤,请简述此操作步骤:
若不完善此步骤,所得溶液浓度(填偏高、偏低、无影响)
(2)配制Na2SO4溶液时,下列操作情况会使结果偏高的是。
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀后,液面低于刻度线,再加水定容
为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
(1)写出上述试剂的化学式:A , B。
(2) 上述操作Ⅰ所用玻璃仪器的名称是;
操作Ⅱ的名称是。
(3) 加过量A时发生有关反应的离子反应方程式为:
、。
(4)检验B是否过量的方法是
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
⑴ 第①步Cu与混酸反应的离子方程式为______________________________;
得到滤渣1的主要成分为______________ _____。
⑵ 第②步加H2O2的作用是_____________________,使用H2O2的优点是_________;调溶液pH的目的是使_______________________________生成沉淀。
⑶ 简述第③步由滤液2得到CuSO4·5H2O的方法是________________________ 。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中,_________________方案不可行,原因是_________________________:
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子