氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:SO2(g)+Cl2(g)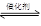 SO2Cl2(l) △H=-97.3kJ/mol。
SO2Cl2(l) △H=-97.3kJ/mol。
有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题:
(1)装置甲中仪器A的名称为_____ _,甲中活性炭的作用是_______ _,B的作用为 ;
(2)装置丁中发生反应的离子方程式为 ;
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 ,分离产物的方法是 (填字母) ;
| A.重结晶 | B.过滤 | C.蒸馏 | D.萃取 |
(4)装置丙的作用为 ,若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为 ;
(5)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 (填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(1)下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。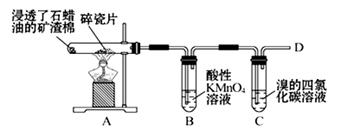
①A中碎瓷片的作用是。
②B中反应类型是。C中实验现象是。(2)制取氯乙烷(CH3CH2Cl)的最佳方法是(用化学方程式表示):;(3)用空气吹溴水到SO2溶液中的化学方程式:;(4)把干海带放在(仪器的名称)中灼烧。灼烧后的海带溶于水中,过滤后的滤液中酸化后加过氧化氢的离子方程式
(5)在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置制取乙酸乙酯。
①试管B中盛放饱和Na2CO3溶液的作用是:中和乙酸、溶解乙醇和。
②实验完成后,若要分离B中的液体混合物,需要用到的玻璃仪器主要是。
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2向处理过的铁屑中加入过量的3mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________________________________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是_________________________ _____。
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是__________________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为_______________(用a、b、c回答)
以下是合成乙酰水杨酸(阿司匹林)的实验流程图,请你回答有关问题:
已知:阿司匹林、水杨酸和乙酸酐的相对分子量分别为:180、138、102。
(1)制取阿司匹林的化学反应方程式为_________________;反应类型____________;
(2)水杨酸分子之间会发生缩合反应生成聚合物,写出除去聚合物并提纯阿司匹林的有关离子反应方程式______________________________、____________________________;
(3)阿司匹林在碱性条件下会发生水解反应,请写出阿司匹林与足量NaOH溶液反应的离子方程式______________________________________________________;
(4)在过程③的抽滤中,用冷水洗涤晶体,其作用_______________________;
(5)根据阿司匹林的结构推测其性质___________;
| A.与纯碱溶液能反应 | B.不能发生加成反应 |
| C.能与氯化铁发生显色反应 | D.水解反应 |
E.不能发生银镜反应F.能发生消去反应
(6)取2.000 g水杨酸、5.400 g乙酸酐反应,最终得到产品1.566 g。求实际产率_________;
某学生实验兴趣小组拟用图1装置来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验。
图1
(1)各仪器接口连接顺序是_________________(用接口字母填写)。
(2)该装置连接好而未装药品前,检验气密性的操作是_________________________。
(3)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有______。(填序号)
| A.在滴入盐酸之前,应排净装置内的CO2气体 |
| B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液 |
| C.在装置②中水换成饱和Na2CO3溶液 |
| D.滴加盐酸不宜过快 |
(4)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置。假定滴定管起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为_______。
(用含V1、V2、V3、m的式子表示)。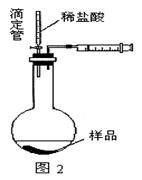
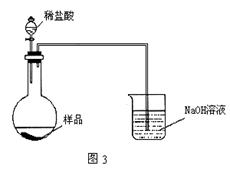
(5)丙同学改用图3装置,通过测定烧杯的质量。你认为乙、丙两同学的方案中,谁的方案更合理__________,理由是:_____________。
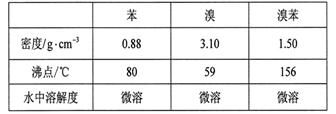
(6分) 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: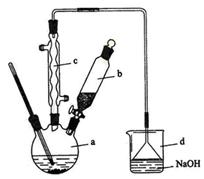
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了__________气体。继续滴加至液溴滴完。装置d的作用是____________________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是除去HBr和未反应的Br2;③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A 25 mL B 50 mL C 250 mL D 509 mL