某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:
(1)装置中试管B的作用是 。
(2)实验中可观察到石英管A中的现象为 。
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。写出该反应的化学方程式 。
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验: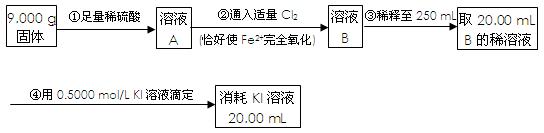
(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(ii)下列有关步骤④的操作中说法正确的是 。
a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为 。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性: >Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2
>Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是________(填化学式);CCl4中显紫红色的物质是_________(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为____________、____________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:________________。将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由__________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是__________________。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+____________________。
某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:

反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.810 9 |
微溶 |
| 正丁醛 |
75.7 |
0.801 7 |
微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是 。
(2)加入沸石的作用是 。
(3)分液漏斗使用前必须进行的操作是 。
(4)反应温度应保持在90~95℃,其原因是 。
(5)本实验中,正丁醛的产率为 。
以下是实验室常用的部分仪器。
请回答下列问题:
(1)序号为⑧和⑩的仪器分别为、(填名称、下同)。
(2)能作反应容器且可直接加热的是 。
(3)在分液操作中,必须用到仪器是 (填序号、下同)。
(4)在配制一定物质的量浓度的溶液时,需要上述仪器中的 。
(5)仪器上标有温度的是 。
(6)下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是________。
a.①是量筒,读数为2.5 mL b.②是量筒,读数为2.5 mL
c.③是滴定管,读数为2.5 mL d.②是温度计,读数是2.5 ℃
(7)某同学想用大理石和稀盐酸反应制取少量CO2。教师指出,若用下列装置制取会浪费大量的稀盐酸。于是该同学选用了上述①~⑩中的一种仪器,添加在下列装置中,解决了这个问题。请你将需要添加的仪器画在下图中的合适位置。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: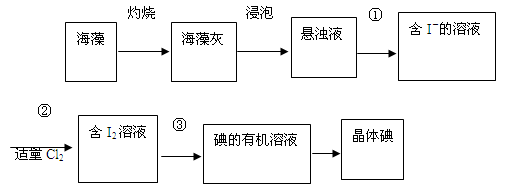
(1)实验操作③的名称是__________,所用主要仪器名称为__________。
(2)提取碘的过程中,可供选择的有机试剂是__________(填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量(填序号)_____溶液,反应的离子方程式为。
A.KIO3B.HClOC.KID.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)。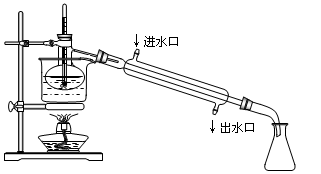
①_________________________,
②_________________________,
③_________________________,
④_________________________。
(5)实验中使用水浴的原因是,最后晶体碘聚集在__________(填仪器名称)中。
某化学兴趣小组为了测定铁碳合金(铁和碳两种单质的混合物)中铁的质量分数,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后______________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为_________________(写表达式)。
(3)装置C的作用______________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是。