化学是以实验为基础的学科。
(1)下列描述正确的是 (填写序号)。
| A.浓硝酸和液溴均保存在棕色试剂瓶中,其目的是防止挥发 |
| B.容量瓶、分液漏斗在使用时需要检验是否漏水 |
| C.海带提碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸发皿、泥三角、三脚架、酒精灯 |
| D.向含有Fe2+的FeCl3溶液中通人Cl2或滴加H2O2均可以除去Fe2+ |
E.检验Na2SO3固体是否被氧化:

(2)某兴趣小组采用如图所示装置制取SO2,并制备硫代硫酸钠(Na2S2O3),反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2;已知硫代硫酸钠受热、遇酸易分解,回答下列问题:

①b中反应的离子方程式为 ,
c中试剂为 。
②反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是 (写物质名称)。
③d中的试剂为 。
④实验中要控制SO2生成速率,可以采取的措施有 (写出两条)。
⑤为了保证硫代硫酸钠的产量,实验中通人的SO2,不能过量,原因是 。
某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式______________________________。
(2)装置A中烧瓶内固体可以选用__________(选填以下选项的代号)。
A.碱石灰 B.生石灰C.二氧化硅 D.氯化钙
(3)上图A—F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
B__________,D__________,E__________。
(4)C装置的反应原理可应用在检查输送氯气的管道是否漏气,写出检查输送氯气的管道是否漏气的化学方程式_______________________。请设计一个实验方案检验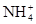 :
:
__________________________________________________________________。
若从装置C的G处逸出的尾气中含有少量Cl2,写出尾气处理的离子方程式:_____________________________________________________________。
. 下列实验操作或对实验事实的描述不正确的是(填序号)
①分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③石油的分馏实验中,需将温度计的水银球插入液面以下以控制液体温度
④用瓷坩埚熔化各种钠的化合物
⑤测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照
⑥向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同
⑦可用饱和碳酸氢钠溶液除去二氧化碳中混有的少量二氧化硫
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:①②、;
(2)从碘水中提取碘所加的有机溶剂可以是(填写化学式),经过操作②后,有机溶剂在(填“上”或“下”)层,呈色。
(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图装置中仪器的名称:
A仪器的名称是,
B仪器的名称是。
(4)指出上图实验装置中的错误之处:
①
②
实验室里需要纯净的氯化钠溶液,但只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案: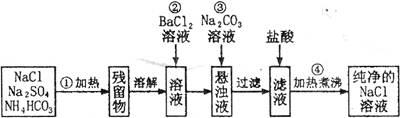
请根据操作流程回答下列问题:
(1)操作 ① 在加热时可选择仪器盛装混合物。
(2)操作 ② 是否可改为加硝酸钡溶液?为什么?。
(3)进行操作 ② 后,如何判断SO42-已沉淀完全?。
(4)操作 ③ 的目的是。
(5)操作 ④ 的目的是。
(18分,每小题2分)用质量分数为98%,密度为1.84g/cm3的浓硫酸来配置500ml,0.2mol/L的稀硫酸。可供选择①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有(填代号).
(2)经计算,需浓硫酸的体积为mL(保留一位小数);。
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒.转移完毕,用少量蒸馏水洗涤2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度cm处,改用滴加蒸馏水,使.塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签.
(4)定容时,俯视刻度线,所配溶液的物质的量浓度将(选填“偏高”、“偏低”或“不变”)