某学习小组进行了如下课外活动,邀请你参与:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:

①写出II实验中发生反应的离子方式: 。
②根据实验发现只要有 等物质生成,水溶液中复分解型离子反应就可以发生。
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些____ 的方向进行(与溶液混合的瞬间相比)。
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对③中的结论作出合理解释: 。
(2)如何研究H2SO4、KC1、NaHSO4、NaNO3、Na2CO3、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。具体如下:
①根据方案进行分类时,经实验测得KC1、NaNO,溶液的pH=7;H2SO4、NaHSO4、NH4Cl溶液的pH<7; Na2CO3、NaOH溶液的pH>7。由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由。____ 、____ 。
②向NaHSO4、NaNO3的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:___ _。反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为 mol,转移电子的物质的量为 mol。
③某同学在用H2SO4鉴别NaNO3、Na2CO3、NaOH溶液时,Na2CO3很容易鉴别,但鉴别NaNO3和NaOH时却陷入了困境。限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:
某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
请回答下列问题:
(1)装置F中发生反应的化学方程式。
(2)装置A中的分液漏斗内液体a宜选用(选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,再关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由(用简要文字并配备化学方程式描述):。
(5)在操作(4)的基础上,引发喷泉操作方法是。
某化学小组用环己醇制备环己烯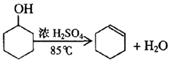
制得的环己烯粗品中含有环己醇和少量酸性杂质等。
(1)为制备环己烯精品:
①加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是。
口进入。蒸馏时要加入生石灰,目的是。
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(2)在环己烯精品中滴加溴的CCl4溶液,发生反应的化学方程式。
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。 已知:常温下,CO能使一些化合物中的金属离子还原。
已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是 (填写“Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的 CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是 。
CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是 。
(2)假设CO2气体为足量, 在实验过程中分别产生以下两种不同情况,请分析并回答问题:
在实验过程中分别产生以下两种不同情况,请分析并回答问题:
①装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
|
(3)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。 。
甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互 溶,加热至160℃即分
溶,加热至160℃即分 解成二氧化碳和氢气。
解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH H2O+CO↑,
H2O+CO↑,
实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
①从下图挑选所需的仪器,画 出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。

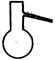


分液漏斗长颈漏斗蒸馏烧瓶集气瓶温度计
②装置Ⅱ的作用是。
(2)实验室可用甲酸制备甲酸 铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3="=" Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O== 2 Cu(HCOO)2·4H2O+ CO2↑
2 Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备: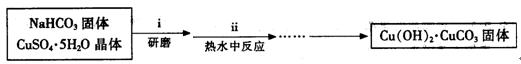
③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是。
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到(填写实验现象),说明温度过高。
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是。
⑥用乙醇洗涤晶体的目的是。
有机高分子化合物A常用作木材的粘合剂,俗称“白乳胶”。B通过加聚反应可制得A。B的蒸气对H2的相对密度为43,分子中C、H、O的原子个数之比为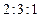 。B在酸性条件下水解可生成碳原子数相同的两种有机物D和M。
。B在酸性条件下水解可生成碳原子数相同的两种有机物D和M。
(1)B分子中含氧的官能团的名称为 。
(2)B的同分异构体中属于不饱和羧酸的有3种,它们是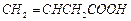 、
、
、 。
(3)写出B在一定条件下生成A的化学方程式 。
(4)通常羟基与双键碳原子直接相连接时,易发生下列转化:
M能发生银镜反应,请写出M的结构简式 。
(5)已知:
D可以发生如下转化关系:
有机物N与G互为同系物,且N的相对分子质量比G大14,写出两分子N在一定条件下生成的六元环状化合物的结构简式 。并写出N发生消去反应的化学方程式 。