【化学——选修2:化学与技术】
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术通常包括煤的气化技术和液化技术。其中煤的液化技术又可以分为_____和______;
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: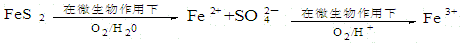
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为___________;第二步反应的离子方程式为____________。
(3)工业煤干馏得到的产品有焦炭、___________、___________等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:_______;
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:______________;
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是 ;
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。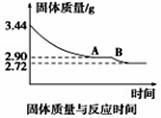
①石膏的化学式为_____________;
②图像中AB段对应化合物的化学式为_______________。
讨论思考下列问题。
(1)“是药三分毒”,谈谈你对此话是如何理解的?
(2)请你设计一幅“毒品对人类危害”的漫画。
某链烃A1mol,在一定条件下完全分解(裂解)成1mol烷烃B和1mol烯烃C,生成的混合气体对氢气的相对密度为14.5.通过计算回答下列问题:
⑴写出链烃A可能的结构简式和名称
⑵烷烃B和烯烃C可能各是什么?
⑶如果要求1molB完全燃烧时需要的氧气的物质的量是整数,那么C只能是什么烯烃?
以下是某同学写出的己烷同分异构体的结构简式,请判断是否有重复和遗漏现象。
为了测定甲烷的分子式,取一定量的甲烷置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。学生甲、乙设计了两个方案,均认为根据自己的方案能求出甲烷的最简式。他们测得的有关数据如下(箭头表示气流的方向,实验前系统内的空气已排尽)。
(1)根据两方案,你认为能否求出甲烷的最简式?
(2)请根据你选择的方案,通过计算求出甲烷的最简式。
(3)丙同学认为若要单纯依靠这些数据,无法确定甲烷的分子式,你是否同意他的观点?说明理由。
小明从小爱吃鱼和瘦肉,不喜欢吃蔬菜水果。于是特别疼爱他的奶奶就将小明的一日三餐安排为:早餐:肉丝面;午餐:红烧鱼、排骨汤、大米饭;晚餐:瘦肉粥、炸鸡腿。请你评价一下小明奶奶的这种膳食安排是否合理,并说明你的依据。