席夫碱类化合物在催化、药物等方面用途广泛。某种席夫碱的合成路线①如下: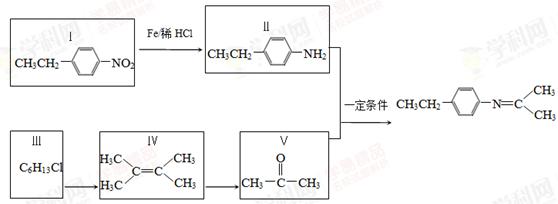
(1)Ⅰ的分子式为________.1 mol Ⅴ完全燃烧至少需要消耗________mol O2。
(2)Ⅲ与NaOH水溶液共热反应,化学方程式为________。
(3)Ⅳ发生聚合反应生成的高分子化合物的结构简式为________。
(4)Ⅰ的一种同分异构体Ⅵ在酸性条件下发生水解,生成物之一遇FeCl3溶液显紫色,Ⅵ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为3︰2,Ⅵ的结构简式为________(写出一种)。
(5)结合合成路线①,分析以下合成路线②:
X的结构简式为________,Z的结构简式为________。
材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的,其中B是气体。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、H、K均为含A元素。其余物质均为中学化学中常见物质。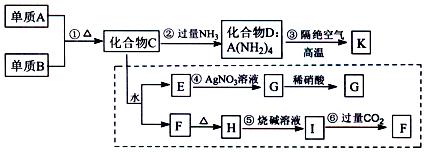
请回答下列问题:
(1)实验室制取A的化学方程式,分别写出A及其氧化物的一种用途、。
(2)写出化学式:化合物C;化合物F。
(3)写出反应③的化学方程式:。
(4)写出反应⑥的离子方程式:。
(5)化合物K与化合物C类似,也能在一定条件下与水反应生成两种化合物,请写出K与水反应的化学方程式:。
丙烯可用于合成一种常用的保湿剂F和具有广泛用途的聚氨酯类高分子材料PU (结构简式为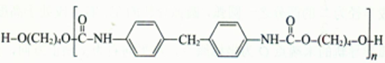 ),合成路线如下图所示(部分反应试剂及生成物、条件省略)。[说明:F的分子式C3H8O3\C的C4H8O2\X的C13H14N2]
),合成路线如下图所示(部分反应试剂及生成物、条件省略)。[说明:F的分子式C3H8O3\C的C4H8O2\X的C13H14N2]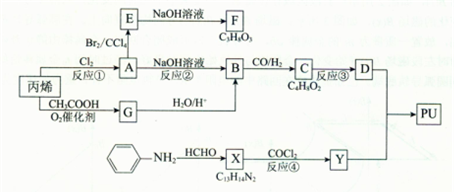
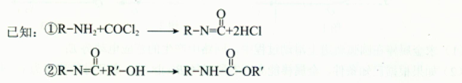
请回答:
(1)保湿剂F也可由油脂经皂化反应制备,F的结构简式是______________。
(2)A中含有官能团的名称是,反应①的反应类型是反应。
(3)反应②的化学方程式是_____________________________________________。
(4)C分子中无甲基,且能发生银镜反应,反应③的化学方程式是________。
(5)由丙烯经G生产B的方法有2个优点,一是避免使用毒性比较大的物质;二是通过操作可分离出可循环使用的乙酸。G的结构简式是_____________。
(6)反应④的化学方程式是________________________________。
合成肉桂酸异戊酯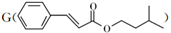 的路线如下:
的路线如下:
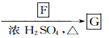
已知:①B和C含有相同的官能团且C在标准状况下的气体密度为1. 964 g/L;
同答下列问题:
(1)F的名称是__________(用系统命名法命名)。
(2)D中含有的官能团的名称是__________________________________________。
(3)E和F反应生成G的化学方程式为__________________________________________。
(4)A的同分异构体中含有苯环的共有_______种(不考虑立体异构且包括A),其中与氯化铁溶液能发生显色反应且核磁共振氢谱有四组峰,峰面积之比为3:2:2:1的是______________(写结构简式)。
已知一个碳原子上同时连有两个羟基时,易发生如下转化: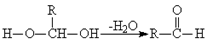
请根据图示回答: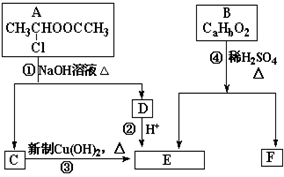
(1)E中含有官能团的名称是_________,③的反应类型是______________,C跟新制的氢氧化铜悬浊液反应的化学方程式为。
(2)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n(H2O) =" 2" :1。F是电脑芯片中高分子光阻剂的主要原料,F具有以下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。则F在一定条件下发生加聚反应的化学方程式为__ ________________________________________________。
(3)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有种结构,写出其中一种同分异构体的结构简式 ______________。
(10分)碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,含氧元素的质量分数为31.58%.A遇FeCl3溶液显紫色,其苯环上的一氯取代物有两种,请回答下列问题:(1)A的分子式是____________________.
(2)若A能与NaHCO3溶液反应,A的结构简式为____________________;写出A与NaHCO3溶液反应的化学方程式__________________________________________________________.
(3)如A可以发生如图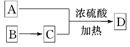 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式为______________________________________________________。
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式为______________________________________________________。
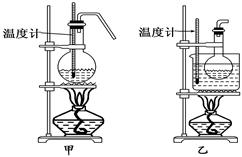
(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度.甲、乙两装置相比较,乙装置有哪些优点________________________.