一定条件下合成乙烯:
6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) △H1
CH2=CH2(g)+4H2O(g) △H1
已知:2H2(g)+O2(g)=2 H2O(g) △H2=-480 kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2 H2O(g) △H3=-1400 kJ•mol-1
(1)△H1= 。请标出该反应电子转移的方向和数目 。
(2)温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 。
A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM >KN
C.催化剂会影响CO2的平衡转化率
(3)若投料比n(H2)∶n(CO2)=3∶1,则图中M点时,乙烯的体积分数为 (保留两位有效数字)。
(4)为提高CO2的平衡转化率,除改变温度外,还可采取的措施有 (任写一条)。
(5)电解法可制取乙烯(下图),电极a接电源的 极,该电极反应式为 。
丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的工艺流程如下: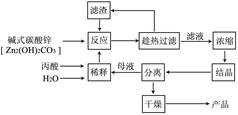
| 序号 |
n(丙酸)∶n(碱式碳锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2h,用水量45g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
(2)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为 。
(3)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下: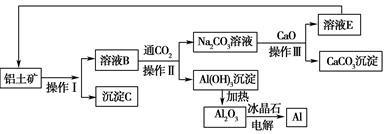
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________。
(2)写出由溶液B生成Al(OH)3的离子方程式:__________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为_____________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
A、B、C、D、E均为有机化合物,它们之间的关系如下图所示(提示:RCH===CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)。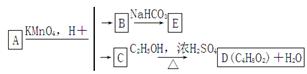
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为__________;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为12,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是__________,反应类型为:__________;
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是__________;
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有__________种,其相应的结构简式是__________。
【试题出处】2012-2013福州一中模拟
在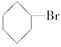 与NaOH的醇溶液共热一段时间后,要证明
与NaOH的醇溶液共热一段时间后,要证明 已发生反应,甲、乙、丙三名学生分别选用了不同的试剂和方法,都达到了预期的目的,请写出这三组不同的试剂名称和每种试剂的作用.
已发生反应,甲、乙、丙三名学生分别选用了不同的试剂和方法,都达到了预期的目的,请写出这三组不同的试剂名称和每种试剂的作用.
第一组试剂名称________,作用__________________;
第二组试剂名称________,作用__________________;
第三组试剂名称________,作用__________________.
氯仿可作为局部麻醉剂,常因保存不慎而被空气中的O2氧化,产生剧毒的气体——光气(COCl2):
2CHCl3+O2―→2COCl2+2HCl。
(1)上述反应________(填选项符号,下同).
A.属于取代反应
B.不属于取代反应
(2)为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是________.
A.NaOH(aq)
B.AgNO3(aq)
C.HCl(aq)
D.水
E.湿润的蓝色石蕊试纸
F.湿润的无色酚酞试纸