25 ℃时,H2SO3 HSO3- +H+的电离平衡常数Ka=1×10-2,下列说法不正确的足
HSO3- +H+的电离平衡常数Ka=1×10-2,下列说法不正确的足
| A.该温度下NaHSO3的水解平衡常数Kb=1×10-12 |
| B.若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3) /c(HSO3-) 将减小 |
| C.略微升高温度 Ka(H2SO3)和Kh(NaHSO3 )均增大 |
| D.NaHSO3溶液中:c(H+)<c(SO32-)+c(HSO3-)+c(OH-) |
将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是
A B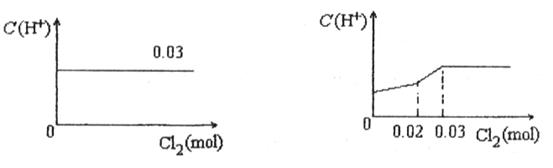
C D
用惰性电极电解2L1mol•L-1的CuSO4溶液,在电路中通过0.5mol电子后,调换电源的正负电极,电路中又通过0.1mol电子,此时溶液中的c(H+)是(假设通电后溶液的体积不变)
| A.0.2mol•L-1 | B.0.6mol•L-1 | C.0.5mol•L-1 | D.0.25mol•L-1 |
能说明醋酸是弱电解质的是
①往苯酚钠溶液中加入醋酸可得苯酚
②醋酸钠溶液呈碱性
③可以用食醋清除热水瓶内的水垢
④pH=2的醋酸溶液稀释1000倍后pH小于5
| A.①③④ | B.①② | C.②④ | D.② |
下列条件下,两瓶气体所含原子数一定相等的是
| A.同质量的C2H4和CO |
| B.同体积、同密度的C2H4和C3H6 |
| C.同温度、同体积的H2和N2 |
| D.同压强、同体积的N2O和CO2 |
下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是
| A.FeCl3 | B.Ca( HCO3)2 HCO3)2 |
C.NaAlO2 | D.Na2SO3 |