SO2、NO2、可吸人颗粒物是雾霾的主要组成。
(1)SO2可用氢氧化钠来吸收。现有0.4 molSO2,若用200 mL,3mol·L—1NaOH溶液将其完全吸收,生成物为 (填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为: 。
(3)氮氧化物和碳氧化物在催化剂作用下可发生反应:2CO+2NO N2+2CO2,在体积为0.5L的密闭容积中,加入0.40mol的CO和0.40 mol的NO,反应中N2的物质的量浓度的变化情况如图所示,从反应开始到平衡时,CO的平均反应速率υ(CO)= 。
N2+2CO2,在体积为0.5L的密闭容积中,加入0.40mol的CO和0.40 mol的NO,反应中N2的物质的量浓度的变化情况如图所示,从反应开始到平衡时,CO的平均反应速率υ(CO)= 。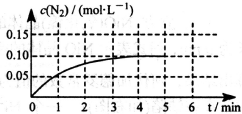
(4)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H>0。
CH3OCH3(g)+3H2O(g)△H>0。
合成二甲醚时,当氢气与二氧化碳的物质的量之比为4︰1,CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率υ逆(CO2) B点的正反应速率为υ正(CO2)(填“>”、“<”或“=")。
②氢气的平衡转化率为 。
(5)液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
A、B、C、D、E代表5种元素。请填空:








(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
第三周期中的半导体材料 |
| B |
L层s电子数比p电子数少1 |
| C |
第三周期主族元素中其第一电离能最大 |
| D |
前四周期呀中其未成对电子数最多 |
(1)B单质分子中,含有________个 键和__________个
键和__________个 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
 (1)某同学提出的假设是;
(1)某同学提出的假设是; (2)通过实验Ⅰ可以证明;
(2)通过实验Ⅰ可以证明; (3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入,再加入。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入,再加入。 (4)探究结果为。
(4)探究结果为。 (5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
(5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
根据下图所示实验回答下列问题:
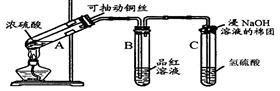
 (1)试管C口部的棉团上发生反应的离子方程式是。
(1)试管C口部的棉团上发生反应的离子方程式是。 (2)试管B中的实验现象是,若将该试管中反应后的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(2)试管B中的实验现象是,若将该试管中反应后的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。 (3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液,则发生反应的化学方程式是。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液,则发生反应的化学方程式是。