(14分)下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题: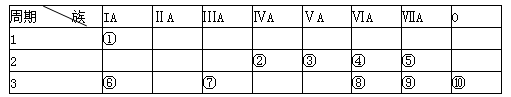
(1)非金属性最强的是 (填元素符号)、化学性质最不活泼的是______(填元素符号)。
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________(填化学式)。
(4)表中能形成两性氢氧化物的元素是 (填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式: , 。
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论: __
X、Y、Z、M、N为原子序数小于18的五种元素,X原子的电子层数等于最外层电子数;X与Y处于同一周期,Y与M可形成离子化合物M2Y,该化合物的水溶液显碱性;Z离子核内质子数与核外电子数之和为18;X、Z、M三种元素的离子具有相同的电子层排布;元素N的原子的质子、中子与电子数之和为2。
根据上述信息回答下列问题:
(1)写出质量数为32的Y原子符号____________,M2Y的电子式为________________。
(2)X、Z、M三种元素的离子半径大小顺序为_________________(用离子符号表示)。
(3)下列说法中正确的是___________________________。
| A.元素Z与元素M形成的化合物中只有极性共价键和离子键 |
| B.元素M和元素N之间不能形成离子化合物 |
| C.元素X的原子比元素M的原子的失电子能力强 |
| D.元素Z与元素N形成的简单化合物比元素Y与元素N形成的化合物稳定 |
(4)写出X、M两元素的最高价氧化物对应的水化物反应的离子方程式:
__________________________________________________________________________。
(5)已知(4)反应中生成的含X元素的化合物与HF、NaCl按l :6 :2的物质的量之比恰好完全反应,得到H2O、HCl和另一种含有三种元素且微溶于水的化合物,写出该反应的化学方程式__________________________________________________________。
(1)已知拆开1molH-H键,lmolN-H键,1mol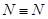 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。已知: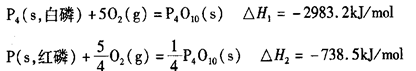
则白磷的稳定性比红磷_____________(填“高”或“低”),理由是________________
__________________________________________________________________________。
( 10 分)
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 2H2O+2PbSO4;
2H2O+2PbSO4;
镍镉碱性充电电池在放电时,其
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为,其在充电时阳极反应为;
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为;
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的
主要原因可能是;
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4mol。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去
Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);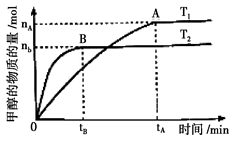
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应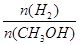 ④处于A点的反应体系从T1变到T2,
④处于A点的反应体系从T1变到T2,
达到平衡时增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)