碳和氮的化合物与人类生产、 生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
| A.增加Ni的量可提高CO的转化率, Ni的转化率降低 |
| B.缩小容器容积, 平衡右移,ΔH减小 |
| C.反应达到平衡后, 充入CO再次达到平衡时, CO的体积分数降低 |
| D.当4v正[Ni(CO) 4]= v正(CO) 时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒, 工业上常用SO2将CO氧化, 二氧化硫转化为单质硫。
(3)对于反应: ,向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
,向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
①比较P1、P2的大小关系: ________________。
②700℃时,在压强为P2时, 假设容器为1L,则在该条件平衡常数的数值为_____ (最简分数形式)
(4)NO2、 O2和熔融NaNO3可制作燃料电池, 其原理如图所示。该电池在使用过程中石墨Ⅰ电极上生成氧化物Y, 其电极反应式为 。若该燃料电池使用一段时间后, 共收集到20mol Y, 则理论上需要消耗标准状况下氧气的体积为 L。
已知X是二氢香豆素类化合物,是香料工业的重要化合物。X可以通过以下线路合成
请根据上图回答:
(1)D中含有的官能团名称是、;反应①属于反应。
(2)化合物B的结构简式为,
或
(3)写出反应⑤的化学方程式(有机物写结构简式,下同)
(4)化合物F 的分子式为C6H6O3,它具有酸性,F中只有两种等效氢原子,写出反应⑦的化学方程式是
(5)化合物Y是X的同分异构体,Y具有如下特点:a.苯环上有两种取代基;b.苯环是的一氯代物只有两种;c 能跟FeCl3溶液发生显色反应,且1molY能与3molNaOH发生反应。写出符合上述特点的Y的结构简式(任写一种)
实验室用乙醇制取乙烯的装置如下图,回答下列问题。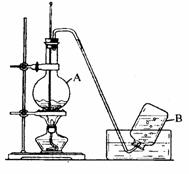
(1)仪器A的名称是;A中加入沸石的目的是;在烧杯中配制A中溶液的方法是;在反应中浓硫酸的作用是;A中发生反应的化学方程式是。
(2)A中产生的气体除乙烯外,还可能混有少量
(填化学式)
(3)用乙烯制聚乙烯的化学方程式为
(1).写出羟基分别与下列基团相结合构成物质的名称:
①—CH2CH2— ; ②CH3—— ;
②CH3—— ;
(2).① 某有机物A,其化学式为CxHyOz,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,且烃基与羟基上氢原子个数比为2:1,它的相对分子质量为62,则其结构简式为。
② 某有机物B对氢气的相对密度为29,燃烧2.9克该有机物,生成3.36升CO2气体,则B的分子式为;取0.58克B与足量银氨溶液反应,析出金属银2.16克,则B的结构简式为;写出B与新制氢氧化铜共热的化学方程式:
有以下各组物质,完成以下各组问题:
| A.氧气与臭氧 |
| B.氕与氘 |
C.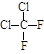 与 与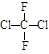 |
| D.乙烯与1-丁烯 |
E.己烷与2,3-二甲基丁烷
(1)以上各组物质属于同系物的是;属于同分异构体的是;属于同素异形体的是;属于同位素的是;属于同一物质的是。
(2)2,3-二甲基丁烷由某烯烃加成得到,则该烯烃的结构简式可能为、。
下图是实验室中制备气体或验 证气体性质的装置图
证气体性质的装置图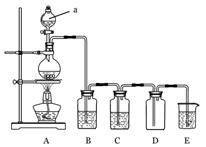
(1)仪器a的名称是_________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为_______________________________________。
②装置B中的溶液为__________________________;
烧杯中溶液的作用为________________ 。
。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是,现象是
②证明SO2具有还原性的现象是
③证明生成气体中含有CO2的现象是
④D装置的作用是。