Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑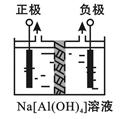
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为 m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是 。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是 。
简答题(7分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为;平衡时SO2浓度为;
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号);
| A.容器内气体的总压强不再发生变化 |
| B.SO2的体积分数不再发生变化 |
| C.容器内气体原子总数不再发生变化 |
| D.相同时间内消耗2nmolSO2的同时消耗nmolO2 |
E.相同时间内消耗2nmolSO2的同时生成nmolO2
填空题( 6分)(1) ①C(s) + O2(g) ="=" CO2(g);ΔH= –393.5kJ/mol
②CO(g) + 1/2 O2(g) ="=" CO2(g);ΔH= –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为____________________________。
(2)已知CH4的燃烧热为890kJ/mol,则24g CH4完全燃烧放出的热量为。
填空题( 24分)(1)25℃、101 kPa下,1 mol 氢气燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为___________________________________________________。
(2) 25℃,101kPa时,16 g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3 kJ热量,则CH4燃烧的热化学方程式为_______________________________________________。
(3)25℃,101kPa时,0.5 mol CO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为,其表示燃烧热的热化学方程式是。
(4)0.50L 2.00mol/L H2SO4与2.00L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为,其表示中和热的热化学方程式为。
(5)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、946 kJ,则25℃,101kPa时,N2与H2反应生成NH3的热化学方程式是。
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A: 4HCl+O2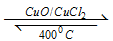 2Cl2+2H2O。
2Cl2+2H2O。
(1)已知:i 反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ii
①H2O的电子式是_______________.
②反应A的热化学方程式是____________________________________________________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),
分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是__________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度高低与投料比多少的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数__________。
将不同量的H2O(气) 和CO 气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O (g) + CO( g) 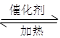 CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
| 实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650℃ |
1 mol |
2 mol |
0.8 mol |
1.2 mol |
5 min |
| 2 |
900℃ |
0.5 mol |
1 mol |
0.2 mol |
0.8 mol |
3 min |
| 3 |
900℃ |
a |
b |
c |
d |
t |
(1)①由以上数据,实验1中以v( CO2) 表示的反应速率为__________。
②该反应在650℃时平衡常数数值为__________,该反应的逆反应为__________ (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t <3min,则a、b 应满足的关系是__________。
(2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是__________ (写2条)
②图2中时刻t2发生改变的条件可能是__________ (写2条)
(3)在850℃时,其平衡常数K = 1,850℃时在该容器中同时充人1.0moICO,3.0 molH2O,1.0molCO2,5.0molH2,此时反应向__________(填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为__________。