实验室用下列装置探究SO2的性质并测定SO2转化为SO3的转化率。
已知:SO3熔点为16.8℃,沸点为44.8℃,且遇水剧列反应。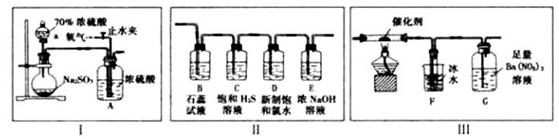
(1)仪器a的名称是________。
(2)装置A的作用除将气体充分混合、干燥气体外,还能________。
(3)I和II连接可验证SO2的性质。
①装置B中现象是__________;装置C中的现象体现了SO2的_______性。
②经验证D瓶中的溶液能使品红试液褪色。请用最简单的方法检验D瓶中含有SO2还是含有氯水:_________。
(4)I和III连接可测定SO2的转化率。
①当停止通入SO2,熄灭酒精灯后需继续通一段时间的O2,目的是________。
②有同学认为,装置G中盛放的溶液可用下列试剂________代替更环保(填序号)。
a.足量BaC12溶液
b.足量Ba(OH)2溶液
c.足量FeC13和BaC12的混合液
d.足量NaHSO2溶液
③实验结束后,若装置F增加的质量为mg,装置G中产生白色沉淀的质量为ng,则此条件下,SO2的转化率为______(用含字母的代数式表示,不用化简)。
(7分)某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。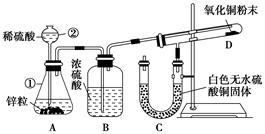
(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。
(12分)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。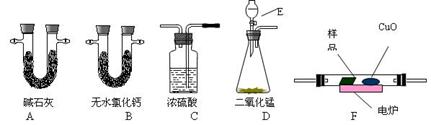
(1)现准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:
(1)按上述所给的测量信息,装置的连接顺序应是
D→→ F→;
(2)A、B管内均盛有固态试剂,A管的作用是______________________;
(3)E中应盛装什么试剂:_______________;
(4)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”或“不变”)
(5)该有机物的实验式为__________________;
(6)要确定该有机物的分子式,还必须知道的数据是___________。
①消耗液体E的质量②样品的摩尔质量③ CuO固体减少的质量
④ C装置增加的质量⑤燃烧消耗O2的物质的量
恒温恒压下,向某可变容积的密闭容器中充入3 L A和2 L B,发生如下反应:3A(g)+2B(g)  xC(g)+yD(g),达到平衡时C的体积分数为m%,若维持温度、压强不变,将0.6 L A、0.4 L B、4 L C、0.8 L D作为起始物质充入密闭容器内,达到平衡时C的体积分数仍为m%,则x=________,y=________.
xC(g)+yD(g),达到平衡时C的体积分数为m%,若维持温度、压强不变,将0.6 L A、0.4 L B、4 L C、0.8 L D作为起始物质充入密闭容器内,达到平衡时C的体积分数仍为m%,则x=________,y=________.
下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
⑴该浓盐酸中HCl的物质的量浓度为 mol·L-1。 ⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取 体积的多少而变化的是。
体积的多少而变化的是。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
⑶某学生欲用上述浓盐酸和蒸馏水配制500 ml 物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 ml 上述浓盐酸进行配制。 ②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I、用量筒量取浓盐酸时仰视观察凹液面()
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水()
③该36.5%的浓盐酸,若加入等质量的水稀释后,质量分数18.25%;若加入等体积的水稀释后,质量分数18.25%(用“小于”或“等于”或“大于”来填空)
掌握仪器的名称、组装及使用方法是中学化学实验的基础,右下图为两套实验装置。

⑴写出下列仪器的名称:
①;②;④;
⑵仪器①~④中,使用时必须检查是否漏水的有。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有;将仪器补充完整后进行的实验操作的名称为:。现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是。