恒温恒压下,向某可变容积的密闭容器中充入3 L A和2 L B,发生如下反应:3A(g)+2B(g)  xC(g)+yD(g),达到平衡时C的体积分数为m%,若维持温度、压强不变,将0.6 L A、0.4 L B、4 L C、0.8 L D作为起始物质充入密闭容器内,达到平衡时C的体积分数仍为m%,则x=________,y=________.
xC(g)+yD(g),达到平衡时C的体积分数为m%,若维持温度、压强不变,将0.6 L A、0.4 L B、4 L C、0.8 L D作为起始物质充入密闭容器内,达到平衡时C的体积分数仍为m%,则x=________,y=________.
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。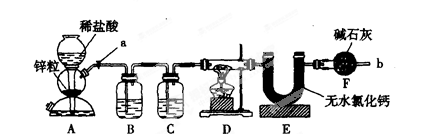
(1)为了安全,在点燃D处的酒精灯之前,在b出口处必须_________________________。
(2)装置B的作用是_ ______________;装置C中装的液体是_______,所起的作用是______。
(3)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是________________________________________。
(4)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为___________g。
(5)U形管E右边又接连干燥管F的目的是____,若无干燥管F,测得Fe2O3的质量将_____(填“偏大”“偏小”或“无影响”)。
(6)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将______(填“偏大“偏小”或“无影响”)。
(本题共10分)(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈 色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是 。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如下图: 。
。
从上图推断甲同学想通过测定 计算摩尔盐的纯度。该方案的不足之处在于 。
(4)乙同学在甲同学的基础上做了改进,其实验装置如下图: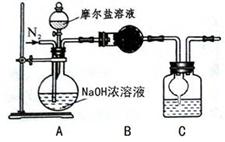 。
。
则B与C中的试剂分别是 和 。C中干燥管的作用是 。乙同学称取了 10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重 0.68g,则依此数据推算这份摩尔盐的纯度为 %(答案精确到小数点后第一位)。
某研究性小组同学在学习相关有机基础知识后,决定试用类似制乙酸乙酯的装置,以环己醇为主要原料制备环己烯。
已知:

(1)制备粗产品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。请回答有关问题:
①A中碎瓷片的作用是_______________,导管B除了导气外还具有的作用是____________;
②试卷C置于冰水浴中的目的是_______________.
(2)制备精品
①环己烯粗品长含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用_______________(填写编号)洗涤;
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从_________口进入(填“g”或“f”)。收集产品时,温度应控制在______℃左右,实验制得的环己烯制品质量低于理论产量,可能的原因是______________________.
(17分)实验室常用的几种气体发生装置如图A、B、C所示: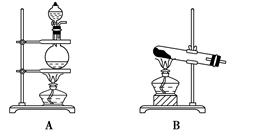
(1)实验室可以用B或C装置制取氨气,如果用B装置,通常使用的药品是________;如果用C装置,通常使用的药品是________;
检查B装置气密性的操作方法是_____________________________________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
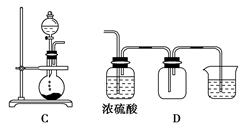
下图是某学生设计收集气体的几种装置,其中不可行的是________。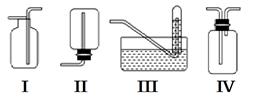
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________
①CO2 ②NO ③Cl2 ④H2
写出A装置中反应的离子方程式____________________________________
其中在D装置中连接小烧杯中应盛放________,目的是_________________________________。
若要收集干燥纯净的X气体,上述装置应如何改进________________________________
(10分)下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线: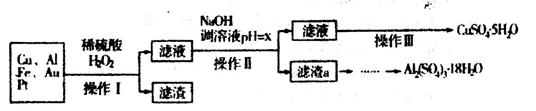
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式______________。
(2)在操作II中,x的取值范围是___________________。
(3)在操作III中,蒸发浓缩需要的玻璃仪器有______________________________________。
(4)由滤渣a制取Al2(SO4)3•18H2O,探究小组设计了三种方案: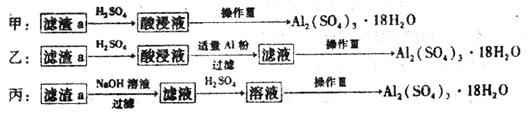
综合考虑上述三种方案,最具可行性的是___________(填序号)。
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol/LEDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4•5H2O晶体的纯度是_________。