(10分)下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线: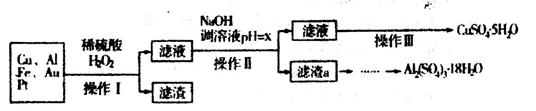
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式______________。
(2)在操作II中,x的取值范围是___________________。
(3)在操作III中,蒸发浓缩需要的玻璃仪器有______________________________________。
(4)由滤渣a制取Al2(SO4)3•18H2O,探究小组设计了三种方案: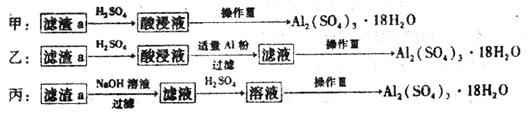
综合考虑上述三种方案,最具可行性的是___________(填序号)。
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol/LEDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4•5H2O晶体的纯度是_________。
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3•3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是______________________;
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成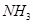 ,写出反应的离子方程式____________________________;
,写出反应的离子方程式____________________________;
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用离子方程式和简要文字表述):
__________________________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol•Lˉ1NaOH溶液、8.0 mol•Lˉ1NaOH溶液、澄清石灰水、0.01 mol•Lˉ1KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2;假设2:气体是_____;假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 |
预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 |
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br一、SO42一、Cl一等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: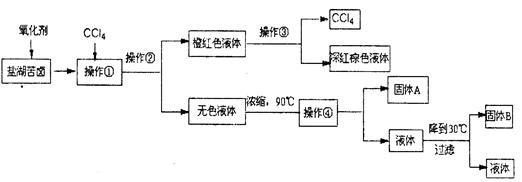
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是。
(2)参照下图溶解度曲线,得到的固体A的主要成分是(填化学式)。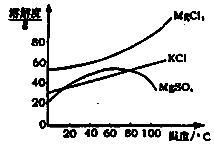
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 |
BaCO3 |
BaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
| Ksp |
8.1×10一9 |
1.08×10一10 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
【设计除杂过程】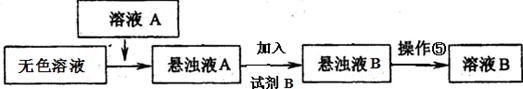
a、已知试剂B是K2CO3溶液,则溶液A的主要成分是(填化学式)。
【获取纯净氯化钾】
b、对溶液B加热并不断滴加l mol· L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是。将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体时,停止加热。
【问题讨论】
c、进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为。
无水硫酸铜在强热下会发生分解反应:
CuSO4  CuO + SO3↑ 2SO3
CuO + SO3↑ 2SO3 2SO2↑+ O2↑
2SO2↑+ O2↑
用下图所示装置(夹持仪器已略去),根据D管在反应前后的质量差计算出分解了的无水硫酸铜的质量。
实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一段时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的已除去二氧化碳等酸性气体的空气。
④再称量D管,得其反应前后的质量差为m。
回答下列问题:
(1)反应2SO3(g) 2SO2(g)+ O2(g)的平衡常数表达式为K=。
2SO2(g)+ O2(g)的平衡常数表达式为K=。
(2)B管中除温度明显升高外,还可看到的现象是,而温度明显升高的主要原因是;B管中发生反应的有关离子方程式是。
(3)仪器E的作用是。
(4)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算出分解了的无水CuSO4的质量?(任选其一回答)
①如果能,则分解的无水CuSO4的质量为(用m表示)。
②如果不能,则原因是。为了能测得分解了的无水硫酸铜的质量,你的简单实验方案是。
现有一瓶实验室放置已久的可能被氧化的Na2SO3固体,为了研究它的组成,请你参与同学们进行的如下探究活动:
可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0.1mol/LH2SO4、0.1mol/LHNO3、0.1mol/LBaCl2、0.1mol/LBa(NO3)2、3%H2O2、10%NaOH溶液、蒸馏水、品红溶液;仪器自选。
(1)提出假设
假设一:固体全部是Na2SO3;假设二:固体全部是Na2SO4;
假设三:。
(2)设计实验方案(略);选用下图装置进行实验,该装置的优点是。
(3)进行实验:请在下表中用简要文字写出实验操作、预期现象和结论。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量固体样品于微型试管中;在W管a处滴入、b处滴入;用胶管将W管与微型试管连接好 |
|
| 步骤2:用针筒吸入,将针头穿过微型试管的胶塞,向固体样品中注入该溶液。 |
。 |
| 步骤3:拨出针筒,吸入蒸馏水洗净;再吸入 注入微型试管中 |
。 |
(4)若将上述探究过程中生成的气体通入到足量的新制漂白粉浓溶液中,则可生成白色沉淀。试写出该反应的离子方程式:。
市售氯化钾中所含杂质以Na+、Mg2+为主,也含有少量SO42—、Fe3+等。提纯过程如下:
(1)操作I所用的玻璃仪器有;操作II的主要步骤是。
(2)滤渣a的主要成分是;滤渣b的主要成分是。
(3)检验BaCl2溶液是否加入过量,其详细操作过程为。
(4)产品KCl晶体可能仍含少量的NaCl,进一步提纯的方法是。