柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br一、SO42一、Cl一等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: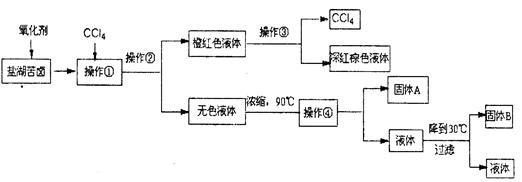
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是 。
(2)参照下图溶解度曲线,得到的固体A的主要成分是 (填化学式)。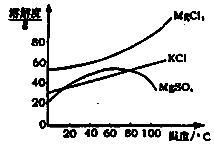
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 |
BaCO3 |
BaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
| Ksp |
8.1×10一9 |
1.08×10一10 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
【设计除杂过程】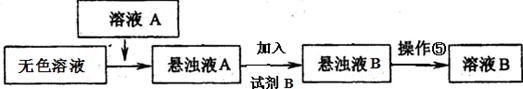
a、已知试剂B是K2CO3溶液,则溶液A的主要成分是 (填化学式)。
【获取纯净氯化钾】
b、对溶液B加热并不断滴加l mol· L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体时,停止加热。
【问题讨论】
c、进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为 。
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验I:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6mol/LHCl或6mol/LH2SO4,其它试剂任选。)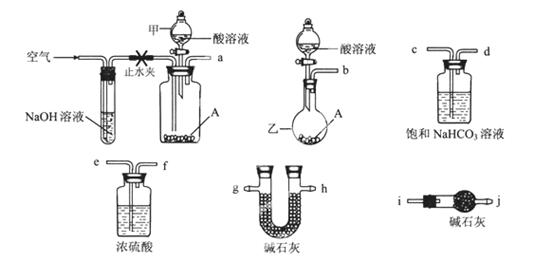
回答下列问题:
(1)仪器乙的名称为________。
(2)请选择必要的装置完成实验II,正确的连接顺序为________ (按气流方向,用接口字母表示);选用的酸溶液是________。
(3)有人提出不采用实验I,可在实验II结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2〜3次,将洗涤液过滤,洗涤沉淀2〜3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是_________________,实际上未采用该方案的原因是不符合实验设计的________原则(填字母编号)。
| A.科学性 | B.安全性 | C.可行性 | D.简约性 |
(4)x与y的关系式是________ (用等式表示)。
(5)通过实验I的相关数据,经计算可得A的摩尔质量为602.0g. mol-1。实验II中称得样品A的质量为9.030g,与足量酸完全反应后,CO2吸收装置增重0.660g,则A 的化学式为________。
某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。
(1)实验前检查装置气密性的方法为________________________________________________________。
(2)检验实验中生成气体的实验操作是_____________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,无气泡 |
| 2 |
取步骤1中溶液,滴加酸性KMnO4溶液 |
紫色褪去 |
紫色褪去 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因是;验证方法为。
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图: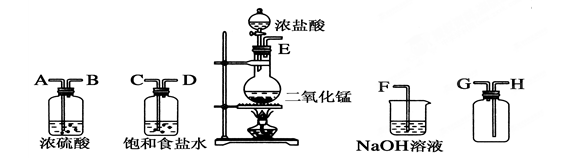
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。
②NaOH溶液中发生的反应:__________________________________________ 。
某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。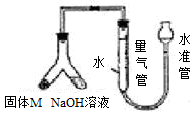
(1)如何检验该装置的气密性。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式。
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL,则固体M中铝的质量(m)范围为。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积(填“>”“<”“=”)VmL。
(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程)(填“符合”或“不符合”)。
I.纯碱、烧碱等是重要的化工原料。
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是___________________,
若其他操作不变,将A与C连接,可观察到的现象是__________________________。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是:
A.NaOH和Na2CO3;B. ;C. ;D. 。
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
| 实验操作 |
实验现象 |
结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
||
| ② |
II.化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应
后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B,C中的反应物外,还有:。
(2)C中反应生成BaCO3的离子方程式是。
(3)下列各项措施中,不能提高测定准确度的是()
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A~B之间增添盛有浓硫酸的洗气装置
D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_________________________________。
(6)装置中U形管D中的碱石灰的作用是_____________________________。