实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。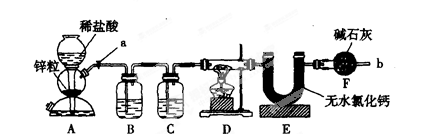
(1)为了安全,在点燃D处的酒精灯之前,在b出口处必须_________________________。
(2)装置B的作用是_ ______________;装置C中装的液体是_______,所起的作用是______。
(3)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是________________________________________。
(4)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为___________g。
(5)U形管E右边又接连干燥管F的目的是____,若无干燥管F,测得Fe2O3的质量将_____(填“偏大”“偏小”或“无影响”)。
(6)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将______(填“偏大“偏小”或“无影响”)。
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁。实验室中利用下图所示装置探究由废铁屑制备FeCl3·6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应)。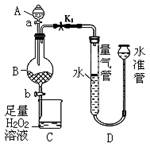
(1)装置A的名称为。
(2)检验该装置气密性的具体操作如下:
①关闭;打开弹簧夹K1;
②向水准管中加水,使水准管液面高于量气管液面;
③。
取m g废铁屑加入B装置中,在A中加入足量的盐酸后进行下列操作:
Ⅰ.打开弹簧夹K1,关闭活塞b,打开活塞a,缓慢滴加盐酸。
Ⅱ.当装置D的量气管一侧液面不再下降时,关闭弹簧夹K1,打开活塞b,当A中溶液完全进入烧杯后关闭活塞a、b。
Ⅲ.将烧杯中的溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(3)用离子方程式表示烧杯中足量的H2O2溶液的作用:。
(4)实验结束后,量气管和水准管内液面高度如上图所示,为了使两者液面相平,应将水准管(填“上移”或“下移”)。
(5)由FeCl3溶液制得FeCl3•6H2O晶体的操作过程中不需要使用的仪器有(填选项序号)。
a.蒸发皿
b.烧杯
c.酒精灯
d.分液漏斗
e.坩埚
f.玻璃棒
g.漏斗
(6)实验结束后,若量气管内共收集到VmL气体(已换算成标准状况),则此废铁屑中铁单质的质量分数为。
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)NaOH溶液稍过量的原因。
(2)加入NaOH溶液的正确操作是(填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是。
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18 J/(g·℃),请根据实验数据写出该反应的热化学方程式。
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量(填“小于”、“等于”或“大于”)57.3 kJ,原因是。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式:________________________________________。
(2)装置A中的烧瓶内固体可选用_________(选填以下选项的代号)。
A.碱石灰
B.生石灰
C.二氧化硅
D.五氧化二磷
E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B,D___________,E。(均填编号)
(4)通入C装置的两根导管左边较长、右边较短,目的是__。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:___;其中氧化剂与还原剂的物质的量之比为;当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为mol-1(用含a、b的代数式表示);
(6)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?。
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②发生反应的离子方程式为 、
(2)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于_____________。
(3)K2FeO4-Zn可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________,该电池总反应的离子方程式为____________________________。
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:。
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是,此时发生反应的化学方程式为(只写主要发生的反应):。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
①。
②。