选做【化学——物质结构与性质】化学中的某些元素是与生命活动密不可分的元素,请回答下列问题。
(1)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是 。
(2)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。以下关于维生素C的说法正确的是 。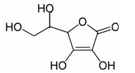
a.分子中既含有极性键又含有非极性键
b.1 mol 分子中含有4 mol π键
c.该物质的熔点可能高于NaCl
d.分子中所含元素电负性由大到小的顺序为O>C>H
(3)维生素C晶体溶于水的过程中要克服的微粒间作用力有 。
(4)KSCN溶液可用于Fe3+的检验,原因是铁离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物。Fe3+的价电子排布为 ,与之形成配合物的分子或离子中的配位原子应具备的结构特征是 。
(5)1183K以下纯铁晶体的晶胞如图1所示,1183K以上则转变为图2所示晶胞,则图1和图2中,铁原子的配位数之比为 。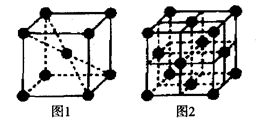
(共4分) A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题: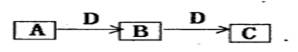
⑴若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B转化为C的化学方程式是:
⑵若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是
(共14分)下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~J在周期表中的位置,回答下列问题:
| 纵行 横行 |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
18 |
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
|||||
| 3 |
F |
G |
H |
E |
I |
J |
⑴上表中元素的最高价氧化物对应的水化物中碱性最强的是_____________(用化学式表示)、酸性最强的是______________(用化学式表示);
⑵J的原子结构示意图为____________;C在周期表的第_________族;
⑶最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是________;
⑷D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)___________>____________>_____________>_____________;
⑸请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)__________________
已知:2Fe3++2I-===2Fe2++I2
2Fe2++Br2===2Fe3++2Br-
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子
是_____________,被氧化的离子的物质的量分别是________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是_____________。
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c________(用含a、b的代数式表示)。
已知A、B为气体单质,其中一种为黄绿色;D为常见金属单质,
C为化合物,它们之间有下列转化关系: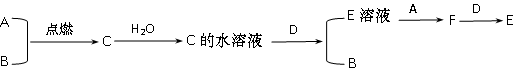
(1)试写出A、B、C、D的化学式:
A;B;C;D。
(2)写出C的水溶液与D反应的离子反应方程式:。
(3)F与D反应的离子反应方程式: ____。
(4)检验F中阳离子的试剂可以用:___________ ____,
现象:_____________________。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为______。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______。
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4