(共17分)Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:____________
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定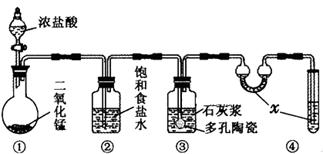
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是____________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3-+ 5I-+ 3H2O = 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将 (填“偏高”、“偏低”或“无影响”)。
(8分) 某学生为验证苯的沸点(80.1℃)比水低,设计了如右图1所示的实验装置:(某些固定装置已略去)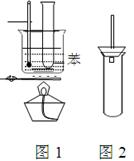
(1)该实验中能够说明苯的沸点比水低的实验现象是。
(2)使用该实验装置的一个明显的缺点就是难以控制苯蒸气的大量外逸,有人在盛苯的试管口装上一个带有直玻璃导管的塞子(如右图2所示) ,改进后装置的直玻璃导管能防止苯蒸气的大量外逸的原因是
(3)该实验的加热方法叫加热, 其优点是
(8分)用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A 100 mL量筒 B玻璃棒 C 50 mL容量瓶 D 10 mL量筒
E 胶头滴管 F 50 mL烧杯 G 100 mL容量瓶
(1)需量取浓硫酸的体积为mL,
(2)实验时不选用的仪器有(填序号),
(3)配制过程中,下列情况会使配制结果偏高的是(填序号) ,
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④浓硫酸在烧杯中稀释后未冷却到室温就转移到容量瓶中定容
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后,再用待配液润洗 |
| C.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀 |
| D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线 |
如图是分离混合物时常用的仪器
(1)写出下列仪器的名称:
AB(各1分)
(2)欲分离下列混合物须使用的仪器是(填写所代表仪器的字母):
①欲分离互不相溶的两种液态物质,须使用
②欲分离悬浮于液体中的固体物质,须使用
③欲分离液态混合物中沸点不同的物质,须使用
下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
(1)用托盘天平称取Na2CO3·10H2O的质量是。
(2)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是。
(3)步骤B通常称为转移,步骤A通常称为。
(4)将上述实验步骤A→F按实验过程先后次序排列。
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(品红溶液;一种常见的红色溶液)C(KBr溶液)D(碘化钾-淀粉溶液)E(水)H(紫色石蕊试液)
(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其化学反应方程式是:
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
下列装置中的现象是B;D
请写出C中的化学方程式
(3)在G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使H处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出G中的反应的化学方程式。
(4)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是。
(5)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作;装置Ⅰ中的现象是。