下列排列顺序不正确的是
| A.原子半径:Si>Na>O | B.热稳定性:HF>HCl>H2S |
| C.碱性:CsOH>KOH>NaOH | D.失电子能力:K>Na>Mg |
有关糖类物质概念的叙述中,正确的是
| A.糖类是具有甜味的物质 | B.糖类是具有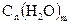 通式的物质 通式的物质 |
| C.淀粉是一种白色粉末,本身没有甜味 | D.葡萄糖是一种单糖的主要原因是含有醛基 |
若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为
| A.10(a+b-12)% | B.10(a+b-14)% | C.10(12-a-b)% | D.10(14-a-b)% |
对于反应A2(g) + 2B2(g)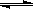 2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是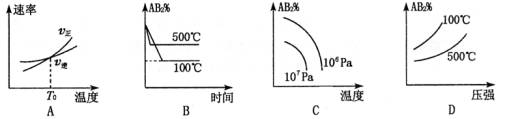
室温时,下列混合溶液的pH一定小于7的是
| A.pH=3的盐酸和pH=11的氨水等体积混合 |
| B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
| C.pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
25℃时,水的电离达到平衡:H2O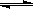 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加人稀氨水 ,平衡逆向移动,c(OH―)降低 ,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |