(本题共12分)CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4∙5H2O的实验室制备流程圈。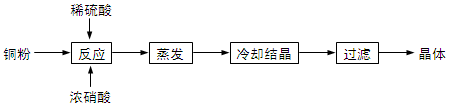
根据题意完成下列填空:
41、向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),在铜粉溶解时可以观察到的实验现象: 。
42、根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为 。
43、已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
称取0.1000g提纯后的CuSO4∙5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4∙5H2O g。
44、在滴定中,眼睛应注视 ;滴定终点时,准确读数应该是滴定管上蓝线所对应的刻度。
45、若上述滴定操作中,滴定管加盐酸之前未进行润洗,则测得试样中所含CuSO4∙5H2O的质量 (填“偏大”“偏小”或“无影响”)。
46、如果l.040g提纯后的试样中含CuSO4∙5H2O的准确值为1.015g,而实验测定结果是1.000g,测定的相对误差为 。
(10分)实验是化学研究的重要手段,贯穿于化学学习的始终。试回答下列中学化学实验室中常见仪器的有关问题:
(1)在仪器①分液漏斗②试剂瓶③集气瓶④滴定管⑤容量瓶⑥量筒⑦托盘天平中,标有"0"刻度的是(填序号,下同) ;标有使用温度的仪器是。
(2)"磨砂"是增加玻璃仪器密封性的一种处理工艺。在仪器①试管②分液漏斗
③细口试剂瓶④广口试剂瓶⑤集气瓶⑥酸式滴定管⑦碱式滴定管中,用到"磨砂"的有
 。
。
(3)在仪器①漏斗②容量瓶③蒸馏烧瓶④分液漏斗⑤烧杯⑥蒸发皿 中,可用于粗盐提纯实验的有;可用于分离两种沸点接近且互不相溶的液态混合物 (即分液)实验的有。
(16分,每空2分)某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据 下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、
下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、 NaOH溶液等试剂)
NaOH溶液等试剂)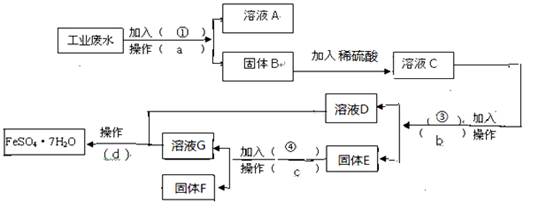 (1)操作a的名称为,所需要的玻璃仪器为____。
(1)操作a的名称为,所需要的玻璃仪器为____。
(2)固体E的成分为 ____,加入的试剂④为__,发生的化学方程式为。
____,加入的试剂④为__,发生的化学方程式为。
(3)加入试剂①的目 的是____________。
的是____________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为、冷却结晶 、
、洗涤、干燥。
(10分,每空2分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是。
A.用量筒量取浓盐酸时俯视观察凹液面
B.摇匀后,液面下降,补充水
C.定容时仰视刻度线
D.在配制前用相同浓度的稀盐酸润洗容量瓶
(2)现将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是mol/L。
(3)在标准状况下,将_____________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得溶质质量分数为36.5%的盐酸。(保留小数点后一位)
(14分,每空2分)请填写下列表格:
| 物质 |
分子数 |
质量(g) |
物质的量(mol) |
标准状况下 气体体积 (L) |
| H2O |
0.5 |
|||
| HNO3 |
3.01×1022 |
|||
| N2 |
14 |
有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用 小试管各
小试管各
盛少量多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产
生沉淀,C与E、D与E产生气体,而C与D无反应现象。
由此,可判定各试剂瓶中所盛试剂为:(填写溶质的化学式)
A 、B 、C 、D 、E
另外,请写出下列离子方程式:
(1)A与E: 。
(2)B与E: 。
|
(3)C与E: 。