(10分)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g) △H=a kJ•mol-1
②3AlCl(g)= 2Al(l)+ AlCl3(g) △H=b kJ•mol-1
反应Al2O3(s)+ 3C(s)=2Al(l)+ 3CO(g)的△H= kJ•mol-1(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)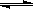 N2(g)+ CO2(g) △H="Q" kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H="Q" kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
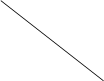 时间(min) 时间(min)浓度 (mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时,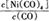 减小,则H0(填“>”或“<”)。
减小,则H0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数(填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol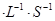 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: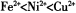 )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。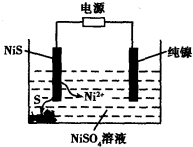
(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。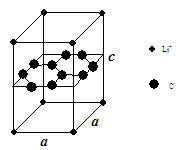
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。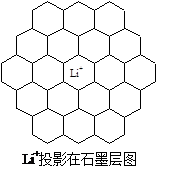
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| BeCO3 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
| 分解温度 |
100℃ |
540℃ |
960℃ |
1289℃ |
1360℃ |
写出BeCO3分解的化学方程式 。
分解温度为什么越来越高? 。
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: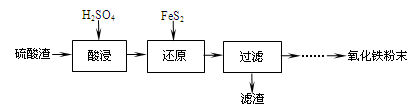
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量。
(4)①可选用(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化:;
b. 沉淀:;
c. 分离,洗涤; d. 烘干,研磨。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为。
②操作A包括;用冰水洗涤的目的是。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比(选填“增大”、“减小”或“不变”)。
分氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是。
(2)工业上氨气可以由氢气和氮气合成。
①该反应的热化学方程式是。
②简述一种检查氨气是否泄露可采用的化学方法:。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
①曲线a对应的温度是。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H2转化率是。
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶
质为。
② (NH4)2SO3显碱性,用化学平衡原理解释。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确
的是(填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
①氨气燃料电池的电解质溶液最好选择(填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是,正极的电极反应方是。