(1)分子式为 的烯烃有3种同分异构体,
的烯烃有3种同分异构体,
其结构简式分别为  ; 和 。
; 和 。
(2)某同学为某烃命名为“1,2—二甲基丙烷”,你认为 (填正确或不正确), 若不正确,请写出正确命名 (若正确,该空不填)。 请写出该烃的同分异构体中含四个甲基的烃的结构简式 。
(3)乙烯是石油裂解的主要产物之一,将乙烯通入溴的四氯化碳溶液中,观察到的现象是 ;其反应方程式为 ,乙烯在一定条件下发生加聚反应的化学方程式是 ,其产物的名称是 ;乙烯对水果具有 功能。
一氧化碳是一种重要的化工原料。
(1)高炉炼铁中发生的反应之一是:
FeO(s)+CO(g) 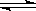 Fe(s)+CO2(g)△H=-1kJ/mol。
Fe(s)+CO2(g)△H=-1kJ/mol。
温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将
(填“增大”、“减小”或“不变”)。
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应.
A.向正反应向向进行 B.处于平衡状态 C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去。在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g) 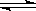 CO2(g)+H2(g) K=1.0
CO2(g)+H2(g) K=1.0
若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为。
(3)用CO和H2经如下两步反应制得甲酸甲醛:
CO+2H2→CH3OH CO+CH3OH→HCOOCH2
已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52;CO最多可制得甲酸甲醛多少吨?(写出计算过程)。
喹硫平可用于精神疾病的治疗,其结构为:
(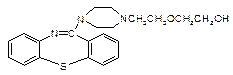 )2·
)2· ,它的合成路线如下:
,它的合成路线如下:
请回答下列问题:
⑴写出分子式为C13H9NO4S的物质的结构简式。
⑵物质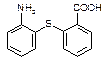 中除硫醚键(-S-)外,还含有的官能团名称为。
中除硫醚键(-S-)外,还含有的官能团名称为。
⑶反应⑦的类型是反应,反应⑤的目的是。
⑷写出反应④的化学方程式。
⑸以 为原料合成
为原料合成 (用合成路线流程图表示,并
(用合成路线流程图表示,并
注明反应条件)。
提示:①已知:苯环上的羧基为间位定位基,如 (主产物);
(主产物);
②合成过程中无机试剂任选,可以利用本题中相关信息。
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料。已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:
(1)铁在元素周期表中位于周期族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:(选用右图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是。
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
| 反应序号 |
化学反应 |
反应热 |
| ① |
Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) |
△H1= -26.7kJ·mol-1 |
| ② |
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) |
△H2= -50.8kJ·mol-1 |
| ③ |
Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) |
△H3= -36.5kJ·mol-1 |
| ④ |
FeO(s)+CO(g)=Fe(s)+CO2(g) |
△H4 |
反应④△H4=kJ·mol-1。
(5)1100℃时, FeO(s)+CO(g) 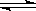 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:。
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:。
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
⑴下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有______(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为(只要求写一种)。
⑶有学者设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为L/min(标准状况)。
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:

已知生成氢氧化物的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
8.3 |
| 完全沉淀pH |
3.7 |
9.6 |
9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有。
(2)由图可知,副反应MnSO4+ SO2  MnS2O6的△H0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是。
MnS2O6的△H0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是。
(3)步骤②中加入MnO2和通入空气的作用。
(4)③中控制温度为60~70℃,温度不宜太高的原因是。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是(写两点)。