(本题共12分)Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。
完成下列填空:
28.若将Na2S2O3中的硫元素看作为+2价,下列反应中与Na2S2O3+H2SO4(稀) → Na2SO4+S↓+SO2↑+H2O属于同一类型的是_______(填序号)。
a.2H2S+SO2→ 3S↓+2H2O
b.3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
c.S+2H2SO4(浓)  3SO2↑+2H2O
3SO2↑+2H2O
d.4P+3NaOH+3H2O → 3NaH2PO2+PH3↑
29.棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
____S2O32―+____Cl2+________ → ___SO42―+___Cl―+___H+
完成并配平该反应方程式;若反应中生成0.2 mol SO42―,则转移电子___________mol。
30.下图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是_______,④是______(填微粒符号)。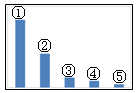
31.已知Na2S溶液显碱性,其主要原因是_________________(用离子方程式解释)。往装有Na2S溶液的烧杯中加入足量的ZnCl2溶液,产生白色的ZnS沉淀;再向烧杯中滴加CuCl2溶液,沉淀转变为黑色。请用溶解平衡原理解释上述现象______________________________________。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
⑩ |
||||||
| 2 |
⑥ |
⑦ |
||||||
| 3 |
② |
③ |
④ |
⑧ |
||||
| 4 |
⑤ |
⑨ |
请回答下列问题:
(1)十种元素中化学性质最不活泼的是(填元素符号);
(2) 在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是(填化学式);
(3) 元素①、②、⑤按原子半径由大到小的顺序依次为(填元素符号),
原因;
(4) 元素⑥的氢化物的化学式为,其水溶液呈_____性(填“酸”、“碱”或“中”);
(5) 灼烧元素②与元素⑧形成的化合物,火焰呈色;
(6)十种元素中(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为。
已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
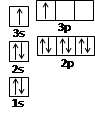
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了。
(2)ACl2分子中A的杂化类型为。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为此观点是否正确(填“正确”或“不正确”),并阐述作出判断的理由:。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式,该物质中K原子和C60分子的个数比为。
(5)C、Si、N原子电负性由大到小的顺序是,NCl3分子的VSEPR模型为。
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电
子排布中,p轨道上只有1个未成对电子。
③Z+与Y 2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为,含有的化学键类型为,Z2Y2为晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为;XY2的结构式为,分子的立体构型为。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是(填名称);晶体ZW的熔点比晶体XW4明显高的原因是。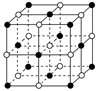
(4)ZW晶体的结构示意图如图。已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d=。
下表为元素周期表的一部分,a、b、c…为元素周期表中前4周期的部分元素。
回答下列问题:
| a |
|||||||||||||||||
| e |
f |
g |
|||||||||||||||
| b |
hh |
||||||||||||||||
| c |
d |
[ |
d |
||||||||||||||
(1)d3+的未成对电子数为个;
(2)请比较e、f、g三种元素的第一电离能由大到小的顺序(写元素符号)
(3)请写出h元素原子价电子轨道表示式;
(4)ea3分子的电子式是,其分子的空间构型是,分子中e原子的杂化类型是。
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的核外电子排布式为。
(2)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是,与同一个N3-相连的X+有个。