乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
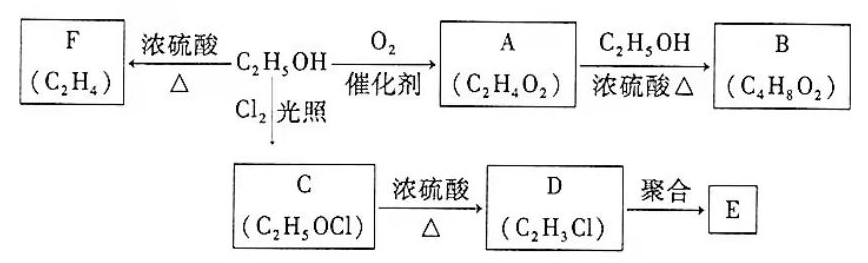
回答下列问题:
(1)
的结构简式为。
(2)
的化学名称是。
(3)由乙醇生产
的化学反应类型为。
(4)
是一种常见的塑料,其化学名称是。
(5)由乙醇生成
的化学方程式为。
(16分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题: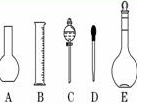
(1)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 ____ mL(计算结果保留一位小数,下同)。
(2)如图所示的仪器中配制溶液肯定不需要的是(填序号),仪器C的名称是,本实验所需玻璃仪器E的名称为
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线,则所配制溶液浓度 ______0.1 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__0.1 mol/L。
(4)下列操作不正确的是(填序号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容时不小心水加多了少许,立即用胶头滴管吸出即可
F.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5)右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
①将________升氯化氢(标准状况)通入1.00L水中可得到36.5﹪的浓盐酸,该浓盐酸中HCl的物质的量浓度为
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
在无土栽培中,配制1 L内含0.5 mol/L NH4Cl、0.16 mol/L KCl、0.24 mol/L K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为,,。
书写下列物质在水溶液中的电离方程式:
CH3COOH:__________________________________
Ca(OH)2:___________________________________
NH3.H2O:________________________________________
NH4HSO4:________________________________________
H2CO3:_______________________________________________
NaHCO3:_______________________________________________
(1)现有以下物质:①NaCl晶体 ②干冰 ③液态的醋酸 ④铜 ⑤BaSO4固体⑥蔗糖⑦酒精 ⑧熔融的KNO3 ⑨浓HNO3
回答下列问题(填序号)
以上物质能导电的是_________________________________;以上物质属于非电解质的是___________________________;以上物质属于电解质的是___________________________;
(14分)如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。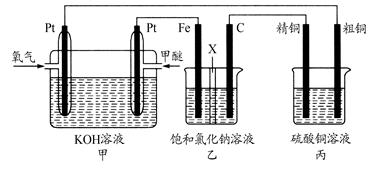
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为___________,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为________;丙装置中阴极析出铜的质量为________。