在体积均为1.0的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1和0.2,在不同温度下反应 达到平衡,平衡时的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
达到平衡,平衡时的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

| A. |
反应

|
| B. | 体系的总压强 总: 总(状态Ⅱ)>2 总(状态Ⅰ) |
| C. | 体系中 ( ): ( ,状态Ⅱ)<2 ( ,状态Ⅲ) |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
下列有关金属腐蚀与防护的说法不正确的是
| A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-===4OH- |
| B.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l)
H2O(l)
ΔH= —57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:
①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是
| A.ΔH1>ΔH3>ΔH2 | B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1=ΔH3>ΔH2 | D.ΔH1>ΔH2>ΔH3 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: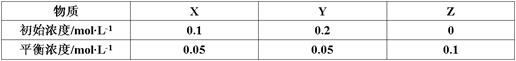
下列说法错误的是
| A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
25 ℃时,浓度均为为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11,下列说法正确的
A.BOH溶于水,其电离方程式是BOH B+ + OH- B+ + OH- |
| B.若将一定量的上述溶液混合后pH = 7,则c(A-)= c(B+) |
| C.在0.1 mol/L BA溶液中,c(B+)> c(A-)> c(OH-)> c(H+) |
| D.若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH = 9 |
下图表示反应N2(g)+3H2(g) 2NH3(g) △H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是
2NH3(g) △H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是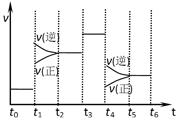
| A.氨气的体积分数最高的一段时间为t5~t6 |
| B.t2~t3和t3~t4时间段氨气的体积分数相等 |
| C.t1时刻改变的条件是降低温度 |
| D.t4~t5时间段平衡向正反应方向移动 |